题目内容
9.(1)有机物A只含有C、H、O三种元素,常用作有机合成的中间体.16.8g该有机物经燃烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和位于分子末端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为6:1:1.A的分子式是C5H8O.A的结构简式是 .
.(2)聚合物
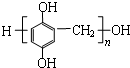 单体是
单体是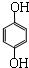 和HCHO,聚合物
和HCHO,聚合物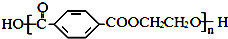 单体是HOCH2CH2OH、
单体是HOCH2CH2OH、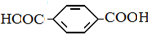
(3)分子式符合C4H6O2的含有碳碳双键和酯基的同分异构体有6种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是CH2=C(CH3)OOCH.
分析 (1)质谱图表明其相对分子质量为84,根据16.8g该有机物经燃烧生成44.0g CO2和14.4g H2O,可计算有机物C、H、O的个数,以此确定有机物分子式,红外光谱分析表明A分子中含有O-H键和位于分子末端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为6:1:1,说明有3种不同的H原子,以此确定结构简式;
(2) 酚和醛的缩聚产物;
酚和醛的缩聚产物;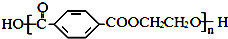 为对苯二甲酸和乙二醇的缩聚产物;
为对苯二甲酸和乙二醇的缩聚产物;
(3)先根据C4H8O2属于酯类的同分异构体,为饱和一元酯,根据酸和醇的种类来确定,然后产生双键并利用顺反异构判断产物的种类;根据氢原子的种类等于峰的数目以及能发生银镜反应说明含有醛基来解答.
解答 解:(1)有机物A只含有C、H、O三种元素,质谱图表明其相对分子质量为84,16.8g有机物A的物质的量为0.2mol,经燃烧生成44.0g CO2,物质的量为1mol,生成14.4g H2O,物质的量为$\frac{14.4g}{18g/mol}$=0.8mol,故有机物A中C原子数目为$\frac{1mol}{0.2mol}$=5,H原子数目为$\frac{0.8mol×2}{0.2mol}$=8,故氧原子数目为$\frac{84-12×5-8}{16}$=1,故A的分子式为C5H8O,不饱和度为$\frac{2×5+2-8}{2}$=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个-OH连接在同一C原子上,故A的结构简式为 ,
,
故答案为:C5H8O; ;
;
(2)聚合物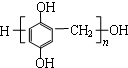 单体是甲醛、
单体是甲醛、 ;
; 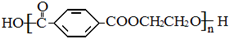 单体是HOCH2CH2OH、
单体是HOCH2CH2OH、 ,
,
故答案为: 和HCHO;HOCH2CH2OH、
和HCHO;HOCH2CH2OH、 ;
;
(3)C4H8O2属于酯类的同分异构体,为饱和一元酯,若为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇有2种,形成的酯有2种,则分子式符合C4H6O2的含有碳碳双键和酯基的同分异构体有4种:HCOOCH2CH=CH2,无顺反异构或HCOOCH=CHCH3,存在顺反异构或HCOO(CH3)C=CH2,无顺反异构,
若为乙酸与乙醇形成的酯,乙酸只有1种结构,乙醇只有1种结构,形成的乙酸乙酯有1种,则分子式符合C4H6O2的含有碳碳双键和酯基的同分异构体有1种:CH3COOCH=CH2,无顺反异构;
若为丙酸与甲醇形成的酯,丙酸只有1种结构,甲醇只有1种结构,形成的丙酸甲酯只有1种,则分子式符合C4H6O2的含有碳碳双键和酯基的同分异构体有1种CH2=CHCOOCH3,无顺反异构;
所以分子式符合C4H6O2的含有碳碳双键和酯基的同分异构体共有6种;
其中核磁共振氢谱有3组吸收峰,即含有3种氢原子,能发生银镜反应,说明含有醛基,所以结构简式是式 CH2=C(CH3)OOCH;
故答案为:6;CH2=C(CH3)OOCH.
点评 本题考查有机物的推断、有机反应类型、官能团的性质、化学计算以及同分异构体的判断等,难度中等,推断有机物A的结构简式是解题的关键,易错点为(3),注意同分异构体的判断.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案| A. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| B. | 价电子排布式为5s25p1的元素位于第五周期第ⅠA族,是s区元素 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 |
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A.
⑥单位时间内生成n molC,同时消耗n mol D.
| A. | ①②③ | B. | ③④⑥ | C. | ②③⑤⑥ | D. | 只有 ③ |
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-15 | 4.0×10-38 |
| 完全沉淀时的pH | ≥5.0 | ≥5.5 | ≥4.0 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶.
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶.
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶.请回答下列问题:
(1)下列与方案③相关的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
(2)方案③中,当Fe3+全沉淀时,溶液中c(Cu2+)的范围为≤2.2mol/L.
| A. | 加入少量的碳酸钠固体 | B. | 通入CO2 | ||
| C. | 加入少量盐酸 | D. | 加入少量氢氧化钙固体 |
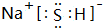 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.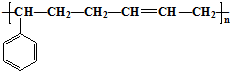 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )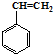 ②
②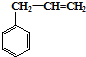 ③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.
③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.