题目内容
20.X、Y、Z、M、N均为短周期主族元素,原子序数依次增大.Y原子最外层电子数与核外电子总数之比为3:4,M与Y同主族,N-、Z+、X+离子的半径逐渐减小,X、N可形成化合物A,常温下A为气体.据此回答:(1)M在周期表中的位置是第三周期ⅥA族,z单质与A的水溶液反应的离子方程式表示为2Na+2H+=2Na++H2↑.
(2)X、Z、M三种元素可形成酸式盐B,则B的电子式为
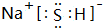 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.(3)X与Y、M可分别形成含有18个电子的分子C和D,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式H2O2+H2S=S↓+2H2O
(4)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量.请写出表示X2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-2a kJ/mol
(5)由X、Y、Z、M四种元素组成化合物E在熔融状态下能电离出两种离子,写出E在水溶液中的电离方程式NaHSO4=H++Na++SO42-.
分析 X、Y、Z、M、N均为短周期主族元素,原子序数依次增大.Y原子最外层电子数与核外电子总数之比为3:4,则Y为氧元素;M与Y同主族,则M为S元素,N原子序数大于S,故N为Cl;N-、Z+、X+离子的半径逐渐减小,由离子电荷可知Z、X处于IA族,X、N可形成化合物A,常温下A为气体,则X为H元素、A为HCl,Z的原子序数大于氧,则Z为Na,据此解答.
解答 解:X、Y、Z、M、N均为短周期主族元素,原子序数依次增大.Y原子最外层电子数与核外电子总数之比为3:4,则Y为氧元素;M与Y同主族,则M为S元素,N原子序数大于S,故N为Cl;N-、Z+、X+离子的半径逐渐减小,由离子电荷可知Z、X处于IA族,X、N可形成化合物A,常温下A为气体,则X为H元素、A为HCl,Z的原子序数大于氧,则Z为Na.
(1)M为S元素,在周期表中的位置是:第三周期ⅥA族,Na单质与HCl的水溶液反应的离子方程式表示为:2Na+2H+=2Na++H2↑,
故答案为:第三周期ⅥA族;2Na+2H+=2Na++H2↑;
(2)H、Na、S三种元素可形成酸式盐B为NaHS,电子式为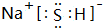 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: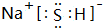 ;离子键、共价键;
;离子键、共价键;
(3)H与O、S可分别形成含有18个电子的分子C和D,C为H2O2、D为H2S,二者反应是方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(4)已知通常状况下1g H2在O2中完全燃烧放出a kJ的热量,表示H2燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-2a kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-2a kJ/mol;
(5)由H、O、Na、S四种元素组成化合物E在熔融状态下能电离出两种离子,E为NaHSO4,在水溶液中的电离方程式为:NaHSO4=H++Na++SO42-,
故答案为:NaHSO4=H++Na++SO42-.
点评 本题是对物质结构的考查,推断元素是解题关键,涉及电子式、离子方程式、热化学方程式、电离方程式等书写,需要学生具备扎实的基础知识,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 某离子结构示意图为: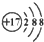 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式为: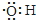 ,可以表示羟基,也可以表示氢氧根离子 ,可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型为: ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 晶体锗的结构为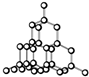 ,其晶胞可表示为 ,其晶胞可表示为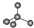 |
| A. | CH3-CH=CH2与HCl加成 | |
| B. | C6H5-CH3在铁粉存在下与氯气反应 | |
| C. | CH3-CH2-CHBr-CH3在氢氧化钠乙醇溶液中加热反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有电子对偏移 | D. | 含有多种非金属元素 |
| A. | 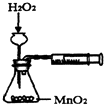 测定反应速率 | B. | 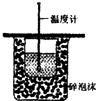 测定中和热 | ||
| C. | 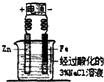 牺牲阳极的阴极保护法 | D. |  铁的吸氧腐蚀实验 |
| A. | 硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 | |
| B. | 氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 | |
| C. | 工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 | |
| D. | 电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
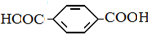
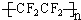 类型加聚反应
类型加聚反应 +3NaOH$\stackrel{△}{→}$3C17H35COONa+
+3NaOH$\stackrel{△}{→}$3C17H35COONa+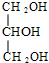 类型水解反应
类型水解反应 类型取代反应.
类型取代反应. .
.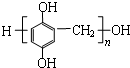 单体是
单体是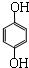 和HCHO,聚合物
和HCHO,聚合物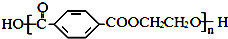 单体是HOCH2CH2OH、
单体是HOCH2CH2OH、