题目内容
14.在一定温度下的定容容器中,发生反应:2A(g)+B(s)?C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A.
⑥单位时间内生成n molC,同时消耗n mol D.
| A. | ①②③ | B. | ③④⑥ | C. | ②③⑤⑥ | D. | 只有 ③ |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:①反应前后气体的体积不变,故混合气体的压强不变不能作为判断是否达到化学平衡状态的依据,故①错误;
②密度=$\frac{总质量}{体积}$,总质量再变,体积不变,故密度会变,故混合气体的密度不变可作为判断是否达到化学平衡状态的依据,故②正确;
③C(g)的物质的量浓度不变可作为判断是否达到化学平衡状态的依据,故③正确;
④平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故容器内A、C、D三种气体的浓度之比为2:1:1不能作为判断是否达到平衡状态的依据,故④错误;
⑤生成nmolD是正反应,同时生成2nmolA是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故⑤正确;
⑥生成nmolC是正反应,同时消耗n mol D,正逆相等,达平衡状态,故⑥正确;
故能表明反应已达到平衡状态的是②③⑤⑥,
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
相关题目
4.证明浓HNO3的氧化性比浓H2SO4的氧化性强的事实是( )
| A. | 浓硝酸加热能放出氧气 | |
| B. | 浓HNO3跟浓盐酸可配制成王水 | |
| C. | HNO3跟金属反应可生成价态不同的氧化物 | |
| D. | 浓HNO3跟铜剧烈反应且不需加热 |
5.下列实验装置能达到实验目的是( )
| A. | 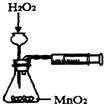 测定反应速率 | B. | 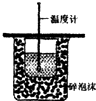 测定中和热 | ||
| C. | 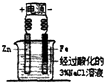 牺牲阳极的阴极保护法 | D. |  铁的吸氧腐蚀实验 |
2.下列物质中,既能与氢气发生加成反应又能使酸性高锰酸钾溶液褪色的是( )
| A. | 苯 | B. | 乙烯 | C. | 乙醇 | D. | 乙烷 |
19.以下实验不能获得成功的是( )
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 提取溶解在水中的少量碘时加入CCl4,分液,取出有机层再分离 | |
| C. | 用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热 | |
| D. | 除去溴苯中的少量Br2时加入KI溶液,充分反应后,弃去水溶液 |
6.l,5一戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效的杀菌作用,无刺激、无腐蚀性,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用.根据上述信息,下列说法中正确的是( )
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物 |
 .
.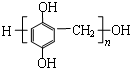 单体是
单体是 和HCHO,聚合物
和HCHO,聚合物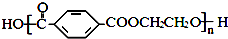 单体是HOCH2CH2OH、
单体是HOCH2CH2OH、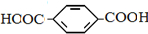
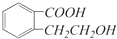 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C.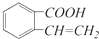 D.
D.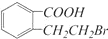
 .
. ;
; .
.