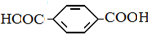
题目内容
19.下列各项叙述中,正确的是( )| A. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| B. | 价电子排布式为5s25p1的元素位于第五周期第ⅠA族,是s区元素 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 |
分析 A.S电子云轮廓图都是球形,但能层越大,球的半径越大;
B.根据主族元素的周期序数=电子层数;最外层电子=主族序数;最后一个电子排在哪个轨道就属于哪个区;
C.根据原子由基态转化成激发态,电子能量增大,需要吸收能量;
D.根据电子排布式的书写方法来解答.
解答 解:A.所有原子任一能层的S电子云轮廓图都是球形,能层越大,球的半径越大,故A正确;
B.价电子排布为5s25p1的元素最外层电子数为3,电子层数是5,最后一个电子排在P轨道,所以该元素位于第五周期第ⅢA族,是P区元素,故B错误;
C.基态Mg的电子排布式为1s22s22p63s2,能量处于最低状态,当变为1s22s22p63p2时,电子发生跃迁,需要吸收能量,变为激发态,故C错误;
D.24Cr原子的电子排布式是:1s22s22p63s23p63d54s1,半充满轨道能量较低,故D错误;
故选:A.
点评 本题主要考查了电子排布式的运用以及轨道形状,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
9.下列物质的鉴别方法不正确的是( )
| A. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| C. | 用品红试液鉴别SO2和CO2两种气体 | |
| D. | 用焰色反应鉴别NaCl、KCl和Na2SO4 |
7.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题.下列实验问题处理方法不正确的是( )
| A. | 制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷气体的纯度 | |
| C. | 实验时将所有的废气通过通风橱排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人 |
14.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以上推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以上推测正确的是( )
| A. | 一定有SO32-离子 | B. | 不一定有CO32-离子 | ||
| C. | 不能确定Cl-离子是否存在 | D. | 不能确定HCO3-离子是否存在 |
4.证明浓HNO3的氧化性比浓H2SO4的氧化性强的事实是( )
| A. | 浓硝酸加热能放出氧气 | |
| B. | 浓HNO3跟浓盐酸可配制成王水 | |
| C. | HNO3跟金属反应可生成价态不同的氧化物 | |
| D. | 浓HNO3跟铜剧烈反应且不需加热 |
11.下列化学用语的理解正确的是( )
| A. | 某离子结构示意图为: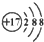 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式为: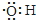 ,可以表示羟基,也可以表示氢氧根离子 ,可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型为: ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 晶体锗的结构为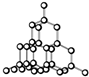 ,其晶胞可表示为 ,其晶胞可表示为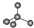 |
8.下列反应后只可能生成一种有机物的是( )
| A. | CH3-CH=CH2与HCl加成 | |
| B. | C6H5-CH3在铁粉存在下与氯气反应 | |
| C. | CH3-CH2-CHBr-CH3在氢氧化钠乙醇溶液中加热反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
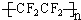 类型加聚反应
类型加聚反应 +3NaOH$\stackrel{△}{→}$3C17H35COONa+
+3NaOH$\stackrel{△}{→}$3C17H35COONa+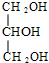 类型水解反应
类型水解反应 类型取代反应.
类型取代反应. .
.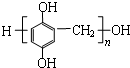 单体是
单体是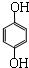 和HCHO,聚合物
和HCHO,聚合物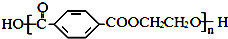 单体是HOCH2CH2OH、
单体是HOCH2CH2OH、