题目内容
2.下列递变情况中,正确的是( )| A. | Na、Mg、Al原子的失电子能力依次增强 | |
| B. | Li、Na、K的最高价氧化物对应的水化物的碱性依次减弱 | |
| C. | Si、P、S元素的气态氢化物的稳定性依次降低 | |
| D. | C、N、O的原子半径依次减小 |
分析 A、同周期,原子序数小的金属性强,越容易失去电子;
B、元素的金属性越强,其最高价氧化物对应的水合物的碱性越强;
C、元素的非金属性越强,其气态氢化物越稳定;
D、同一周期,原子序数越大,半径越小,据此解答.
解答 解:A、Na、Mg、Al位于同一周期,且原子序数逐渐增大,最外层电子数依次增多,故失电子能力减弱,故A错误;
B、Li、Na、K位于同一主族,且原子序数逐渐增大,同主族元素随核电荷数的增大元素的金属性逐渐增强,则对应最高价氧化物的水化物的碱性逐渐增强,故B错误;
C、Si、P、S位于同一周期,从左到右,原子半径逐渐减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,非金属性逐渐增强,对应的氢化物的稳定性逐渐增强,故C错误;
D、同周期元素从左到右原子半径逐渐减小,由于原子序数O>N>C,故D正确;
故选D.
点评 本题考查根据同周期、同主族元素的结构、性质的递变规律,题目难度不大,注意把握元素周期律的主要内容.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.如图为周期表的一部分,所有元素都是主族元素,不正确的是( )
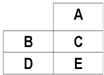

| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |
7.自来水厂生产自来水的工艺流程示意图如图所示

“加氯”是指加入含有氯元素的物质,该物质可以是( )

“加氯”是指加入含有氯元素的物质,该物质可以是( )
| A. | 氯气 | B. | ClO2 | C. | NaCl | D. | NaClO3 |
14.国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”.我国政府 即将启动“酱油补铁工程”.这里的铁指( )
| A. | 铁元素 | B. | 铁单质 | C. | 四氧化三铁 | D. | 三氧化二铁 |
 利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.
利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.