题目内容
7.下列离子方程式或化学方程式与所述事实相符且正确的是( )| A. | 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 表示硫酸与氢氧化钡反应的中和热的热化学反应方程式为:$\frac{1}{2}$ H2SO4(aq)+$\frac{1}{2}$ Ba(OH)2(aq)=$\frac{1}{2}$ BaSO4(s)+H2O(l)△H=-57.3 kJ/mol | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
分析 A.0.1 mol/L、pH=1的NaHA,说明NaHA为强酸的酸式盐,在水中完全电离生成钠离子、氢离子、A2-离子;
B.铁粉过量,反应生成硝酸亚铁;
C.生成硫酸钡沉淀放出热量;
D.NH4Al(SO4)2溶液中加入Ba(OH)2恰好使硫酸根反应,则二者物质的量为1:2,钡离子与硫酸根离子反应生成硫酸钡,铝离子与氢氧根离子反应生成氢氧化铝沉淀,氨根离子与氢氧根离子反应生成一水合氨.
解答 解:A.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液,反应实质是NaHA电离生成氢离子与氢氧根离子反应生成水,离子方程式:H++OH-=H2O,故A正确;
B.稀硝酸中加入过量铁粉,离子方程式:3Fe+8H++2NO3-═Fe3++2NO↑+4H2O,故B错误;
C.中和热是强酸强碱稀溶液中和反应生成1mol水放出的热量,生成硫酸钡沉淀放出热量,所以$\frac{1}{2}$ H2SO4(aq)+$\frac{1}{2}$ Ba(OH)2(aq)=$\frac{1}{2}$ BaSO4(s)+H2O(l)△H<-57.3 kJ/mol,故C错误;
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,离子方程式:NH4++Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+Al(OH)3↓+NH3•H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意酸式盐电离方式及反应物用量对反应的影响,注意中和热定义,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.用电火花点燃装在一密闭容器中的一种气态烃和足量的氧气,完全燃烧后,容器内气体体积保持不变(气体体积均在120℃和相同的压强下测定),这种气态烃不可能是( )
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C3H6 |
16.巴豆酸是一种对胃肠道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3-CH=CH-COOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④乙醇 ⑤酸性高锰酸钾溶液试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③④ | D. | 全部 |
17.下列说法中正确的是( )
| A. | Na2O2分子中所有原子最外层均达到8电子稳定结构 | |
| B. | NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 | |
| C. | 同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物 | |
| D. | NH4Cl仅由非金属元素组成,所以它是共价化合物 |
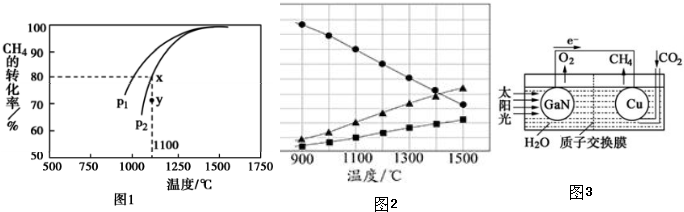
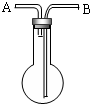 利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.
利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.