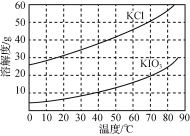
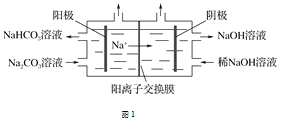
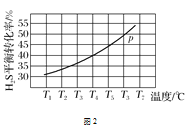
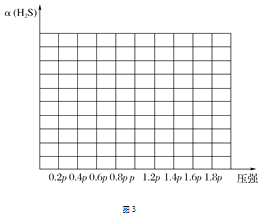
题目内容
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
【答案】A
【解析】
A.在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数,故A正确;
B.K只随温度的改变而改变,如果改变温度,平衡常数会变,故B错误;
C.K只随温度的改变而改变,所以改变压强并加入催化剂,平衡常数也不会发生变化,故C错误;
D. K只随温度的改变而改变,增加A和B的浓度,平衡常数也不会改变,故D错误;
正确答案:A

练习册系列答案
相关题目