题目内容
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
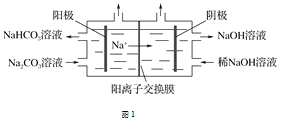
(1)图1为用电解法制备H2,写出阳极的电极反应式:____________________________。
(2)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是________。
A.将研究方向专注于紫外光区,无需考虑可见光区
B.研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C.研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D.研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=-206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:__________________________________。
(4)利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图2所示:
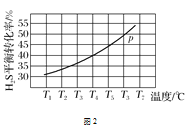
①温度为T4 ℃时,初始体积为1 L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
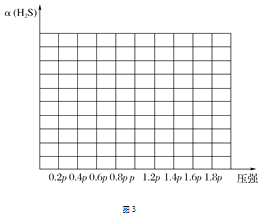
②若保持恒温T ℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图3上画出不同起始压强下H2S转化率的趋势图。 _________________
【答案】4CO32-+2H2O-4e-=O2↑+4HCO3- BCD CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=-165.0 kJ·mol-1 ![]() 或2.2 ×10-2
或2.2 ×10-2 
【解析】
(1)根据图示可知,阳极放电的离子应为水电离出的OH-,放电生成氧气,从而导致溶液中H+浓度增大;
(2) 阻碍了光解水的实际应用的因素有光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等;
(3)由盖斯定律计算可得;
(4)①依据题给数据和平衡常数公式计算可得;
②纵坐标为转化率,在压强小于p时,未达到平衡,随着压强的增大,反应速率增大,转化率增大;压强达到p后,达到平衡,此时随着压强增大,平衡向左移动,转化率下降。
(1)根据图示可知,阳极放电的离子应为水电离出的OH-,放电生成氧气,从而导致溶液中H+浓度增大,H+与CO32-再反应生成HCO3-,电极反应式为4CO32-+2H2O-4e-=O2↑+4HCO3-,故答案为:4CO32-+2H2O-4e-=O2↑+4HCO3-;
(2)A、可见光区更有普遍性,更有发展前途,故错误;
B、根据题意,研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料,故正确;
C、根据题意,研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料,故正确;
D、红外光也是生活中常见光源,研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能,故正确;
BCD正确,故答案为:BCD;
(3)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的化学方程式应为CH4(g)+2H2O(g)=CO2(g)+4H2(g),根据盖斯定律,该反应的ΔH=2ΔH1-ΔH2=-165 kJ·mol-1,则该反应的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=-165 kJ·mol-1,故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=-165 kJ·mol-1;
(4)①根据图示,T4 ℃达到平衡时,平衡转化率为40%,则平衡时H2S为0.18 mol,H2为0.12 mol,S2为0.06 mol,总物质的量为0.36 mol,因为是恒压容器,刚开始时体积为1 L,则平衡时体积为1.2 L,因此平衡时H2S、H2和S2的浓度分别为0.15 mol·L-1、0.1 mol·L-1和0.05 mol·L-1,则平衡常数K=![]() ≈2.2 ×10-2,故答案为:
≈2.2 ×10-2,故答案为:![]() 或2.2 ×10-2;
或2.2 ×10-2;
②纵坐标为转化率,在压强小于p时,未达到平衡,随着压强的增大,反应速率增大,转化率增大;压强达到p后,达到平衡,此时随着压强增大,平衡向左移动,转化率下降,则不同起始压强下H2S转化率的趋势图为 ,故答案为:
,故答案为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。