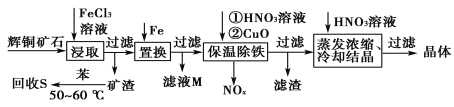
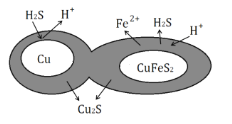
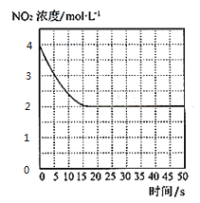
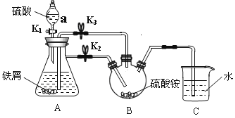
题目内容
【题目】25℃时,体积均为V0且pH相同的MOH与ROH溶液,分别加水稀释至V,pH随![]() 变化如图所示。下列说法正确的是( )
变化如图所示。下列说法正确的是( )
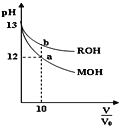
A.MOH为一元强碱
B.a点溶液的导电性大于b点溶液
C.原溶液中:c(MOH)=c(ROH)
D.水的电离程度:a点小于b点
【答案】A
【解析】
A.25℃时体积均为V0且pH都为13的MOH与ROH溶液,分别加水稀释10倍,pH变为12的MOH为强碱,pH大于12的ROH为弱碱,所以MOH是强碱、ROH是弱碱,故A正确;
B.溶液导电性与离子浓度成正比,离子浓度:a<b,则导电性:a<b,故B错误;
C.pH相同的一元碱,碱浓度:强碱<弱碱,MOH是强碱、ROH是弱碱,则原溶液浓度:c(MOH)<c(ROH),故C错误;
D.碱抑制水电离,碱溶液中c(OH)越大其抑制水电离程度越大,碱中c(OH):a<b,则水电离程度a>b,故D错误;
答案选A。

练习册系列答案
 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。