题目内容
【题目】H2S废气资源化的原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,如图为H2S燃料电池示意图。下列说法正确的是( )
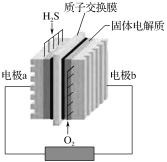
A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+4H++4e-=2H2O
C.电路中每流过4 mol电子,电池会产生632 kJ热能
D.22.4 L H2S参与反应时,2 mol H+经质子交换膜进入正极区
【答案】B
【解析】
由方程式可知,通入硫化氢的一极为负极,硫化氢在负极上失电子发生氧化反应被氧化,通入氧气的一极为正极,氧气在正极上得电子发生还原反应被还原。
A项、H2S燃料电池,通入H2S的电极a为负极,通入氧气的电极b为正极,故A错误;
B项、由于存在质子交换膜,因此溶液为酸性条件,氧气在正极上得电子发生还原反应被还原,电极反应式为:O2+4H++4e-=2H2O,故B正确;
C项、原电池是化学能转化为电能的装置,不是转化为热能,故C错误;
D项、没有标明是否为标准状况,不能计算22.4 L H2S的物质的量,故D错误;
故选B。

练习册系列答案
相关题目