题目内容
【题目】多尺度复杂化学系统模型可以用量子化学计算小区间内(如生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是__________(填“非极性”或“极性”)分子。
②碳负离子CH3-的立体构型为____________。
③根据等电子原理,NO+的电子式为________________。
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。
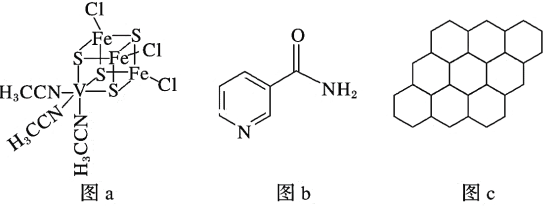
①V2+基态时核外电子排布式为____________________________________________。
②钒固氮酶中钒的配位原子有_____________________________(填元素符号)。
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有_______________________,1 mol该分子中含σ键的数目为________。
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为________;请你预测硅是否容易形成类似石墨烯的结构,并说明理由:___________________________________。
【答案】非极性 三角锥形 ![]() 1s22s22p63s23p63d3(或[Ar]3d3) S、N sp2、sp3 15NA 0.5NA 不容易,硅原子半径大,3p轨道不易形成π键
1s22s22p63s23p63d3(或[Ar]3d3) S、N sp2、sp3 15NA 0.5NA 不容易,硅原子半径大,3p轨道不易形成π键
【解析】
(1)①乙炔是为直线型对称结构,分子中正负电荷重心重合;
②计算CH3-离子中C原子价层电子对数、孤电子对数,进而确定其空间构型;
③等电子体结构相似,NO+与氮气互为等电子体;
(2)①V元素原子核外电子数为23,失去4s2上2个电子形成V2+;
②配位原子提供孤对电子;
(3)根据N原子价层电子对数,确定N原子杂化方式;单键为σ键,双键含有1个σ键、1个π键,注意C的四价结构;
(4)由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形含有6×![]() =2,计算12石墨烯中碳原子数目,进而计算含有的正六边形数目;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键。
=2,计算12石墨烯中碳原子数目,进而计算含有的正六边形数目;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键。
(1)①乙炔是为直线型对称结构,分子中正负电荷重心重合,属于非极性分子;
②CH3-离子中C原子价层电子对数为3+![]() =4,含有1对孤电子对数,其空间构型为三角锥形;
=4,含有1对孤电子对数,其空间构型为三角锥形;
③NO+与氮气互为等电子体,NO+中N原子与O原子之间形成3对共用电子对,其电子式为![]() ;
;
(2)①V元素原子核外电子数为23,失去4s2上2个电子形成V2+,则V2+基态时核外电子排布式为1s22s22p63s23p63d3(或[Ar]3d3);
②由图可知,N和S提供孤对电子,则钒固氨酶中钒的配位原子是S与N;
(3)由烟酰胺结构式可知,分子中氨基中N原子成3个σ键、含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,而环中N原子成2个σ键、含有1对孤电子对,杂化轨道数目为3,采取sp2杂化;分子中含有4个C-H键、2个N-H键、3个C-C键、2个C-N键、4个双键,其中单键均为σ键,双键含有1个σ键、1个π键,则每个分子中含有15个σ键,故lmol该分子中含σ键数目为15NA;
(4)12g石墨烯中碳原子的物质的量为![]() =1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形平均含有碳原子数为6×
=1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形平均含有碳原子数为6×![]() =2,则一共含有的正六边形数目为1mol×
=2,则一共含有的正六边形数目为1mol×![]() ×NAmol-1=0.5NA;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,硅不容易形成类似石墨烯的结构。
×NAmol-1=0.5NA;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,硅不容易形成类似石墨烯的结构。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |