题目内容
20.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为b(V0−V1)ymol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
分析 制备BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl2•2H2O,
(1)研磨将块状固体变成粉末状,可以增大反应物的接触面积,增大反应速率;溶液中质量分数=m(溶质)m(溶液)×100%,实验室用37%的盐酸配置15%的盐酸,需量取浓盐酸的体积和水的体积,且需使用烧杯作为容器稀释,玻璃棒搅拌;
(2)根据流程图和表中数据分析加入NH3•H2O调节pH=8可除去Fe3+,加入NaOH调pH=12.5,可完全除去Mg2+,除去部分Ca2+,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入过量H2C2O4,易发生Ba2++H2C2O4═BaC2O4↓+2H+,产品的产量减少;
(3)根据滴定管的构造分析0刻度在滴定管的位置;利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行,根据Ba2++CrO42-═BaCrO4↓、2CrO42-+2H+═Cr2O72-+H20,与Ba2+反应的CrO42-的物质的量为总盐酸的物质的量减去过量的盐酸,BaCl2溶液的浓度计算公式,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大.
解答 解:(1)化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,溶液中质量分数=m(溶质)m(溶液)×100%,实验室用37%的盐酸配置15%的盐酸,需计算出浓盐酸的体积和水的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器稀释选择a,玻璃棒搅拌加速溶解选择c,
故答案为:增大接触面积从而使反应速率加快;ac;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,
故答案为:Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少;
(3)无论酸式还是碱式滴定管,0刻度都位于滴定管的上方;步骤Ⅱ:待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H20 的盐酸的物质的量为:V1×10-3×bmol,步骤Ⅰ:用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:(V0−V1)b×10−3y×10−3mol/L=(V0−V1)bymol/L,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大,
故答案为:上方;(V0−V1)by;偏大.
点评 本题考查了实验室利用毒重石制备BaCl2•2H2O的设计方法,侧重考查影响反应速率的因素、实验基本操作、沉淀溶解平衡的应用等知识,实验步骤结合物质的性质分析是解答的关键,题目难度中等.

 等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T℃时,该反应的平衡常数K=4(c0−c1)2c12 | |
| B. | T℃时,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1
已知:
碳的燃烧热△H1=a kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
| A. | 3a+b-c | B. | c-3a-b | C. | a+b-c | D. | c-a-b |
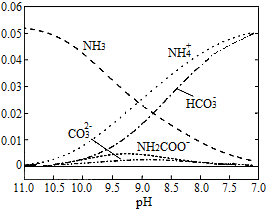
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,c(OH−)c(NH3•H2O)不断增大 | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |

| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
| A. | NaHSO4溶液与Ba(OH)2溶液反应 | B. | C6H5ONa溶液与CO2反应 | ||
| C. | NaAlO2溶液与CO2反应 | D. | Fe与稀硝酸反应 |
| A. | 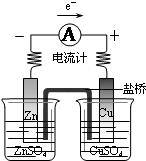 探究原电池原理 探究原电池原理 | B. |  制备无水氯化铁 | C. | 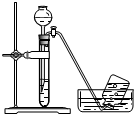 探究铁与水反应 探究铁与水反应 | D. |  收集氨气 收集氨气 |
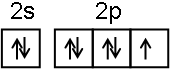 ;NF3中心原子轨道的杂化类型为sp3.
;NF3中心原子轨道的杂化类型为sp3.