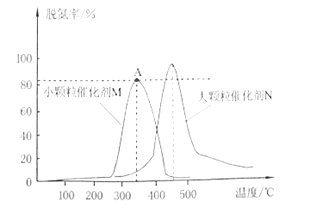
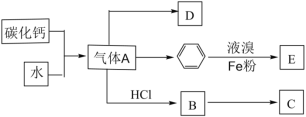
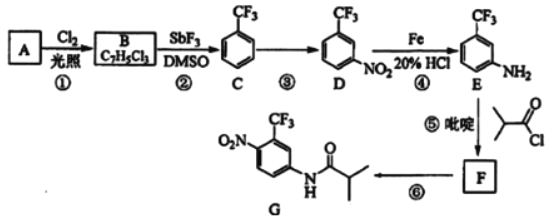
题目内容
【题目】金刚石、石墨烯和![]() 都是碳的同素异形体,其结构示意图如图:
都是碳的同素异形体,其结构示意图如图:

(1)金刚石属立方晶系,每个晶胞所包括的C原子个数为_____________。
(2)金刚石、石墨烯、木炭和![]() 都是由碳元素组成的单质。下列关于碳的单质的叙述正确的是_______(填序号)。
都是由碳元素组成的单质。下列关于碳的单质的叙述正确的是_______(填序号)。
A.都是黑色固体
B.碳原子的排列方式不相同
C.这四种物质都很软,可作润滑剂
D.在氧气中充分燃烧时都生成二氧化碳
E.一定条件下,木炭转化成金刚石是物理变化
(3)金刚石质硬但脆,金刚石能被砸碎的原因是_______________________________。
(4)观察计算一个![]() 分子结构中含有____________个正五边形和_________个正六边形。
分子结构中含有____________个正五边形和_________个正六边形。
(5)石墨烯是单层的石墨,它是世界上已知的最薄、最坚硬的新型材料,有良好的导电性,具有很好的应用前景。石墨烯中碳原子的杂化轨道类型为___________;碳碳键的键角是___________。
(6)碳化硅(![]() )的结构与金刚石类似,设碳化硅的密度为
)的结构与金刚石类似,设碳化硅的密度为![]() ,碳化硅晶体内碳硅键的键长为________________
,碳化硅晶体内碳硅键的键长为________________![]() (用NA表示阿伏加德罗常数的值,列表达式即可)。
(用NA表示阿伏加德罗常数的值,列表达式即可)。
【答案】8 BD 共价键具有方向性,当受到大的外力作用会发生原子间错位而断裂 12 20 ![]() 杂化 120°
杂化 120° 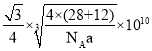
【解析】
(1)根据晶胞结构来数即可,顶点上的原子按![]() 来计算,面心上的原子按
来计算,面心上的原子按![]() 来计算,晶体内的原子按1个来计算;
来计算,晶体内的原子按1个来计算;
(2)对四种同素异形体进行分析即可,注意同素异形体为不同的物质,因此之间的转化属于化学变化;
(3)金刚石是由碳原子通过共价键形成的原子晶体,因此在讨论其物理性质时应从共价键的角度来分析;
(4)可以根据假设法来进行推算(具体步骤见详解部分);
(5)观察石墨烯的结构不难发现,每个碳原子只与另外3个碳原子成键,而碳原子理论上应该形成4个共价键,因此说明必有一个键是双键;
(6)一个金刚石晶胞内有8个碳原子,因此一个碳化硅晶胞内有4个![]() ,再列出密度的表达式来计算即可。
,再列出密度的表达式来计算即可。
(1)顶点![]() 面心
面心![]() 晶体内
晶体内![]() ;
;
(2)A.金刚石即钻石,明显不是黑色固体,A项错误;
B.正因为碳原子的排列方式不同,形成了不同同素异形体,B项正确;
C.金刚石的硬度极大,C项错误;
D.四种物质都可以被氧气充分氧化,变为二氧化碳,D项正确;
E.木炭和金刚石是两种物质,既然生成了新物质肯定是化学变化,E项错误;
答案选BD;
(3)共价键具有方向性,当受到大的外力作用会发生原子间错位而断裂;
(4)
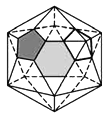
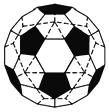
切掉的每个顶点由一个正五边形面代替,每个正五边形有5条边,所以,一共新增加![]() 条棱。原来的正二十面体有30条棱(从图中左图很容易数出来)仍在,所以,
条棱。原来的正二十面体有30条棱(从图中左图很容易数出来)仍在,所以,![]() 就一共有
就一共有![]() 条棱。最后说面数的变化,原正二十面体的20个面还在(虽然形状由正三角形变为正六边形),又切出12个正五边形面,所以一共是
条棱。最后说面数的变化,原正二十面体的20个面还在(虽然形状由正三角形变为正六边形),又切出12个正五边形面,所以一共是![]() 个面;
个面;
(5)石墨烯为片层结构,杂化类型为![]() 杂化,碳碳原子之间形成六元环,键角是120°;
杂化,碳碳原子之间形成六元环,键角是120°;
(6)根据密度公式![]() 先求出晶胞的体积,化简后进一步求出边长为
先求出晶胞的体积,化简后进一步求出边长为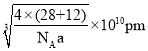 ,根据晶胞结构不难看出碳硅键为体对角线的
,根据晶胞结构不难看出碳硅键为体对角线的![]() ,因此给边长乘以
,因此给边长乘以![]() 即可。
即可。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
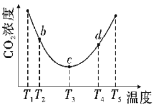
小学生10分钟应用题系列答案【题目】下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气泡产生 c极无变化 | d极溶解 c极有气泡产生 | 电流计指示在导线中 电流从a极流向d极 |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c