题目内容
【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2中Cl元素的价态为_______。
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①在NaClO2溶液脱硝的主要反应中,参加反应的n(ClO2-):n(NO)=_________,增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐_______(填“升高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
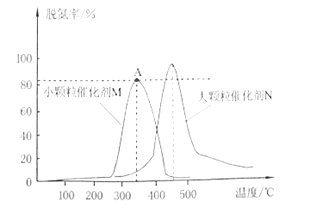
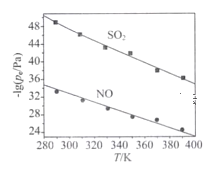
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:
 =
=
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
【答案】+3 3:4 提高 降低 大于 SO2的还原性强于NO 增大 ![]()
【解析】
(1)根据在化合物中,元素化合价的代数和为零进行解答;
(2)①NaClO2溶液脱硝过程中,NO转化为NO3-、NO2-,主要转化为NO3-,书写离子方程式时运用得失电子守恒、电荷守恒和元素守恒,得到4NO+3ClO2-+4OH=4 NO3-+2H2O+3Cl。上述反应是气体分子数减小的反应,增加压强有利于反应正向进行,使NO的转化率提高;
②根据上述反应可知,随着吸收反应的进行,溶液中c(H+)逐渐增大,pH逐渐减小;
③由实验结果看出,溶液中含硫离子的浓度大于含氮离子的浓度,所以脱硫反应速率大于脱硝反应速率。这可能是因为NO溶解度较低、脱硝反应活化能较高等;
(3)①纵坐标是平衡分压的负对数,反应温度升高,SO2和NO的平衡分压的负对数减小,即平衡分压增大,说明平衡逆向移动,所以平衡常数减小;
②根据平衡常数表达式的规则书写即可。
(1)NaClO2中,钠元素的化合价是+1价,氧元素的化合价是-2价,设Cl元素的化合价为x,则(+1)+x+(-2)![]() 2=0,则x=+3价;
2=0,则x=+3价;
(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+,故参加反应的n(ClO2-):n(NO)=3:4;
正反应是体积减小的,则增加压强,NO的转化率提高;
②根据反应的方程式2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+、2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐降低;
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强于NO,易被氧化;
(3)①由图分析可知,反应温度升高,O2和NO的平衡分压减小,这说明反应向正反应方向进行,因此脱硫、脱硝反应的平衡常数均增大;
②反应ClO2+2SO32=2SO42+Cl的平衡常数K表达式为K=![]() 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气泡产生 c极无变化 | d极溶解 c极有气泡产生 | 电流计指示在导线中 电流从a极流向d极 |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c