题目内容
【题目】常温下,下列关于NaOH溶液和氨水的说法正确的是( )
A.25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为20:1
B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH )均减小
D.体积相同、pH相同的两溶液能中和等物质的量的盐酸
【答案】C
【解析】
A、将pH=9的NaOH溶液XL与pH=4的H2SO4溶液YL混合,若所得混合溶液的pH=7,则10-5X=10-4Y,![]() ,所以NaOH溶液与H2SO4溶液的体积比为10:1,故A错误;
,所以NaOH溶液与H2SO4溶液的体积比为10:1,故A错误;
B、pH=13的NaOH溶液稀释100倍,pH为11; 氨水是弱碱,加水稀释电离平衡正向移动,pH=13的氨水稀释100倍,11<pH<13,故B错误;
C、NH4Cl抑制氨水电离,NH4Cl与氢氧化钠反应生成氨水和氯化钠,所以两溶液中分别加入少量NH4Cl固体,c(OH )均减小,故C正确;
D、pH相同的NaOH溶液和氨水,氨水的浓度大于氢氧化钠,体积相同、pH相同的两溶液中和盐酸时,氨水消耗的盐酸多,故D错误。

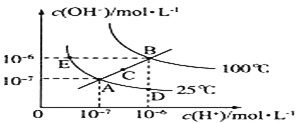
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。