题目内容
(9分)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
(1)列式计算该反应在120~180s与180~240s区间的平均反应速率_______、__________。比较两者大小可得到的结论是_______________________。
(2)列式计算15 ℃时该反应的平衡常数_________________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有_________(要求写出两条)。
 O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(2)列式计算15 ℃时该反应的平衡常数_________________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有_________(要求写出两条)。
(1)
 ;
; .随着反应的的进行,反应物的浓度降低,反应速率减慢 (2)
.随着反应的的进行,反应物的浓度降低,反应速率减慢 (2)  或
或 ; (3)增加OH-的浓度,移去产物。
; (3)增加OH-的浓度,移去产物。试题分析:(1)根据题意结合表格的数据可知在120~180s内的反应速率是
 。在180~240s内的反应速率是
。在180~240s内的反应速率是 由反应速率的数值可以看出:随着反应的的进行,反应物的浓度降低,反应速率减慢。(2)在15 ℃时该反应的平衡常数是
由反应速率的数值可以看出:随着反应的的进行,反应物的浓度降低,反应速率减慢。(2)在15 ℃时该反应的平衡常数是 ;(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有增加其它反应物浓度的方法或减小生成物浓度的方法。因此对该反应来说,就是可采取增大OH-的浓度,移去产物的方法。
;(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有增加其它反应物浓度的方法或减小生成物浓度的方法。因此对该反应来说,就是可采取增大OH-的浓度,移去产物的方法。
练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( ) (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表
 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1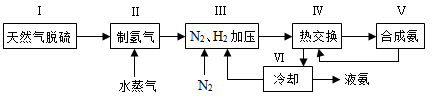
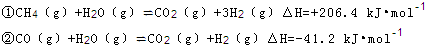
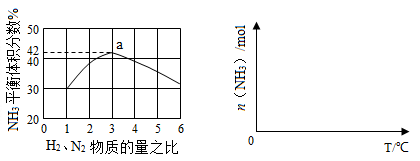
 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求:
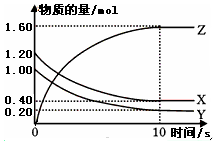
 2Z
2Z