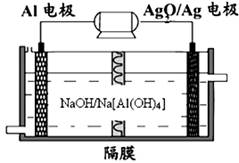
题目内容
(10分,每空2分) 往一个容积为5L的密闭容器中,通入2molN2和3molH2,在一定条件下,发生反应 N2+3H2 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求:
(1)2 min时,N2的物质的量 ; (2)2 min时,H2的物质的量浓度 ;
(3)2 min时,H2的转化率 ; (4)2min内,N2的平均反应速率 ;
(5)N2、H2、NH3的反应速率之比 。
 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求:(1)2 min时,N2的物质的量 ; (2)2 min时,H2的物质的量浓度 ;
(3)2 min时,H2的转化率 ; (4)2min内,N2的平均反应速率 ;
(5)N2、H2、NH3的反应速率之比 。
(1)1.5mol (2)0.3mol/L (3) 50% (4) 0.05mol/(L· min) (5)1:3:2
试题分析:(1)2 min后测得容器中生成了1mol NH3,根据反应方程式可知:每消耗1mol的N2,就会产生2mol的NH3。现在产生了1mol NH3,因此反应消耗了0.5mol的N2,所以反应后还存在N2的物质的量为2mol-0.5mol=1.5mol;(2)根据反应方程式可知:每消耗3mol的H2,就会产生2mol的NH3。现在产生了1mol NH3,因此反应消耗了1.5mol的H2,所以2 min时,H2的物质的量浓度是(3mol-1.5mol)÷5L=0.3mol/L;(3) 在2 min时,H2的转化率是(1.5mol÷3mol)×100%=50%。(4)在2min内,N2的平均反应速率是0.5mol÷5L÷2min=0.05mol/(L· min).(5)由于在相同的时间内三种物质的物质的量变化关系是N2:0.5mol;H2:1.5mol;NH3:1mol。V=(Δn÷v)÷Δt.由于体积相同、时间相等,所以速率比等于物质的量的变化的比。因此N2、H2、NH3的反应速率之比0.5mol:1.5mol:1mol=1:3:2。

练习册系列答案
相关题目
 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是 ( )
2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是 ( )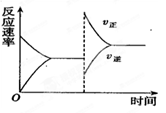
 O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题: 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是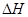 变大
变大
 cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )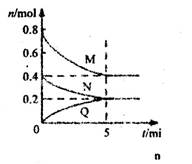
 3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是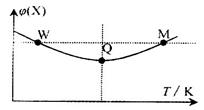
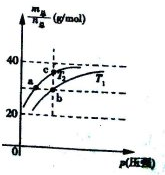
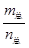 =69g/mol时,若n(NO2):n(N2O4)=2:1,
=69g/mol时,若n(NO2):n(N2O4)=2:1,
 N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下: