题目内容
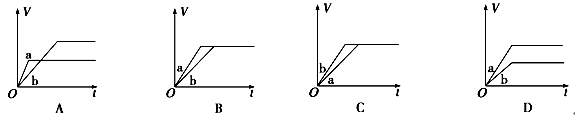
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是

A
试题分析:将a锌粉与稀硫酸反应时加入少量CuSO4溶液,少量锌粉先于CuSO4反应置换出Cu,Zn- Cu、稀硫酸构成原电池,加快了反应速率,但是由于有一部分Zn与CuSO4反应了,故生成的氢气比b中少,A正确。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
题目内容


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案