题目内容
(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)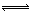 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1
一种工业合成氨的简易流程图如下:
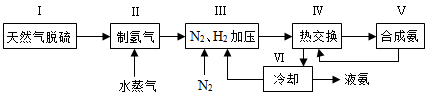
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:
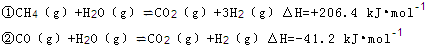
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
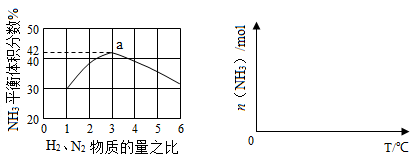
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
N2(g)+3H2(g)
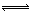 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:
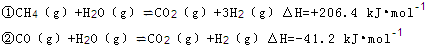
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
(1)2NH4HS +O2 = 2NH3?H2O+2S↓
(2)a 90%
(3)14.5%
(4)
(5)IV; 对原料气加压;分离液氨后。未反应的N2、H2循环使用。
(2)a 90%
(3)14.5%
(4)

(5)IV; 对原料气加压;分离液氨后。未反应的N2、H2循环使用。
试题分析:(1)O2把NH4HS 氧化为S,可得化学方程式:2NH4HS +O2 = 2NH3?H2O+2S↓
(2)a、反应①为吸热反应,反应速率加快,平衡向右移动,H2的百分含量增大,正确;b、增大水蒸气浓度,H2的百分含量减小,错误;c、加入催化剂,H2的百分含量不变,错误;d、降低压强,反应速率减小,错误;设CO的转化量为x
CO + H2O
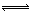 CO2 + H2
CO2 + H2转化量(mol) 0.2 0 0.8
转化量(mol) x x x
转化量(mol) 0.2-x x 0.8+x
1mol+ x =1.18mol,则x=0.18mol,可得CO转化率=0.18mol÷0.2mol×100%=90%
(3)根据图1可知H2与N2的投料比为3,平衡时NH3体积分数为42%,设H2物质的量为3amol,N2物质的量为amol,N2转化的物质的量为x则
N2 + 3H2
 2NH3
2NH3转化量(mol) a 3a 0
转化量(mol) x 3x 2x
转化量(mol) a-x 3a-3x 2x
2x÷(4a-2x)×100% = 42%,解得x = 0.592a,则N2的平衡体积分数=(a—0.592a)÷(4a—2×0.592a)×100% = 14.5%
(4)随着反应的进行,NH3的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,NH3的物质的量逐渐减小,可画出图像。
(5)步骤IV为热交换,使合成氨放出的热量得到充分利用;对原料气加压,使平衡向正反应方向移动,分离液氨,减少生成物浓度,未反应的N2、H2循环使用等措施可提高提高合成氨原料总转化率。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
 3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是 CO(g)+H2(g)
CO(g)+H2(g)  CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图: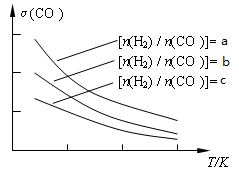
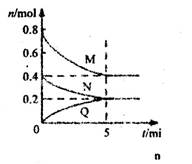
 N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是 
 O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题: cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )