��Ŀ����
CO2�������г����Ļ�����֮һ���������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬�����CO2�������о����ۺ������������ӡ�
���ڴ��������£����ɼ״���CO2ֱ�Ӻϳ�̼�������(DMC)��CO2 + 2CH3OH �� CO(OCH3)2 + H2O�����״�ת����ͨ�����ᳬ��1%��������Լ�÷�Ӧ����ҵ������Ҫԭ��ij�о�С���������������������£�ͨ���о��¶ȡ���Ӧʱ�䡢���������ֱ��ת����(TON)��Ӱ�������۴����Ĵ�Ч�������㹫ʽΪ��TON��ת���ļ״������ʵ���/���������ʵ�����
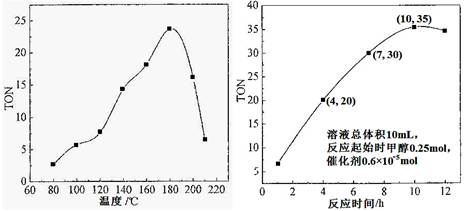
��1�����ݷ�Ӧ�¶ȶ�TON��Ӱ��ͼ����ͬʱ���ڲⶨ�����жϸ÷�Ӧ���ʱ��H________0�����������������������������____________________________________��
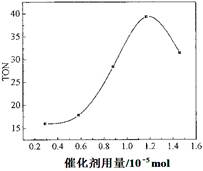
��2�����ݷ�Ӧʱ���TON��Ӱ��ͼ����ͼ������֪��Һ�����10mL����Ӧ��ʼʱ�״�0.25mol������0.6��10��5 mol��������¶��£�4��7 h��DMC��ƽ����Ӧ���ʣ�________��
��3�����ݸ��о�С���ʵ�鼰����������TON��Ӱ��ͼ��������ͼ�����ж�����˵����ȷ���� ��
A���ɼ״���CO2ֱ�Ӻϳ�DMC���������ü״���Ӱ�컷������������CO2 ת��Ϊ��Դ������Դѭ�����úͻ����������涼������Ҫ����
B. �ڷ�Ӧ��ϵ�����Ӻ��ʵ���ˮ��������߸÷�Ӧ��TON
C. ��������������1.2��10��5 molʱ�����Ŵ������������ӣ��״���ƽ��ת�����������
D. ��������������1.2��10��5 molʱ�����Ŵ�������������DMC�IJ��ʷ��������½�
��.��������ڵ�CO2����˳���ų������������ж���������Һ���Ե������������������ҺpH��Ӱ�죬����ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3-)ά��pH�ȶ�����֪��������ѪҺ����������ʱ��H2CO3��һ�����볣��Ka1=10-6.1��c(HCO3-):c(H2CO3)��20:1��lg2=0.3��
(4)��������ݿ������������ѪҺ��pH________(����һλС��)��
(5)��������ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪ�� ��
(6)���������ᡢ�����ѪҺ��ʱ��ѪҺpH�仯������ԭ�������������������������� ��
���ڴ��������£����ɼ״���CO2ֱ�Ӻϳ�̼�������(DMC)��CO2 + 2CH3OH �� CO(OCH3)2 + H2O�����״�ת����ͨ�����ᳬ��1%��������Լ�÷�Ӧ����ҵ������Ҫԭ��ij�о�С���������������������£�ͨ���о��¶ȡ���Ӧʱ�䡢���������ֱ��ת����(TON)��Ӱ�������۴����Ĵ�Ч�������㹫ʽΪ��TON��ת���ļ״������ʵ���/���������ʵ�����
��1�����ݷ�Ӧ�¶ȶ�TON��Ӱ��ͼ����ͬʱ���ڲⶨ�����жϸ÷�Ӧ���ʱ��H________0�����������������������������____________________________________��


��2�����ݷ�Ӧʱ���TON��Ӱ��ͼ����ͼ������֪��Һ�����10mL����Ӧ��ʼʱ�״�0.25mol������0.6��10��5 mol��������¶��£�4��7 h��DMC��ƽ����Ӧ���ʣ�________��
��3�����ݸ��о�С���ʵ�鼰����������TON��Ӱ��ͼ��������ͼ�����ж�����˵����ȷ���� ��
A���ɼ״���CO2ֱ�Ӻϳ�DMC���������ü״���Ӱ�컷������������CO2 ת��Ϊ��Դ������Դѭ�����úͻ����������涼������Ҫ����
B. �ڷ�Ӧ��ϵ�����Ӻ��ʵ���ˮ��������߸÷�Ӧ��TON
C. ��������������1.2��10��5 molʱ�����Ŵ������������ӣ��״���ƽ��ת�����������
D. ��������������1.2��10��5 molʱ�����Ŵ�������������DMC�IJ��ʷ��������½�
��.��������ڵ�CO2����˳���ų������������ж���������Һ���Ե������������������ҺpH��Ӱ�죬����ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3-)ά��pH�ȶ�����֪��������ѪҺ����������ʱ��H2CO3��һ�����볣��Ka1=10-6.1��c(HCO3-):c(H2CO3)��20:1��lg2=0.3��
(4)��������ݿ������������ѪҺ��pH________(����һλС��)��
(5)��������ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪ�� ��
(6)���������ᡢ�����ѪҺ��ʱ��ѪҺpH�仯������ԭ�������������������������� ��
��1������ ������ͬ�ķ�Ӧʱ�䣬�¶Ƚϵ�ʱ����Ӧδ�ﵽƽ�⣻�¶Ƚϸ�ʱ����Ӧ�Ѵﵽƽ�⣬�����¶����ߣ�TON��С����ƽ�������ƶ���˵���÷�Ӧ���� ��2��1��10-3 mol��L-1��h-1
��3��AB (4) 7.4 (5)c(HCO3-)��c(H2CO3)��c(OH-)��c(H+)
(6)�����������ѪҺ��ʱ��HCO3-����H+������Ӧ��ά��ѪҺ��pH�ȶ��������������ѪҺ��ʱ��H2CO3����OH_������Ӧ��ά��ѪҺ��pH�ȶ�
��3��AB (4) 7.4 (5)c(HCO3-)��c(H2CO3)��c(OH-)��c(H+)
(6)�����������ѪҺ��ʱ��HCO3-����H+������Ӧ��ά��ѪҺ��pH�ȶ��������������ѪҺ��ʱ��H2CO3����OH_������Ӧ��ά��ѪҺ��pH�ȶ�
�����������1������ͼ���֪��������ͬ�ķ�Ӧʱ�䣬�¶Ƚϵ�ʱ����Ӧδ�ﵽƽ�⣻�¶Ƚϸ�ʱ����Ӧ�Ѵﵽƽ�⣬�����¶����ߣ�TON��С����ƽ�������ƶ���˵���÷�Ӧ���ȡ�
��2������ͼ���֪��4��7 h��DMC�仯��Ϊ30��20��10�������TON��ת���ļ״������ʵ���/���������ʵ�����֪��ת���ļ״����ʵ�����0.6��10��5 mol��10��6��10��5 mol����Ũ����6��10��5 mol��0.01L��6��10��3 mol/L������DMC��Ũ����3��10��3 mol/L������4��7 h��DMC��ƽ����Ӧ���ʣ�3��10��3 mol/L��3h��1��10-3 mol��L-1��h-1��
��3��A���ɼ״���CO2ֱ�Ӻϳ�DMC���������ü״���Ӱ�컷������������CO2 ת��Ϊ��Դ������Դѭ�����úͻ����������涼������Ҫ���壬A��ȷ��B���ڷ�Ӧ��ϵ�����Ӻ��ʵ���ˮ�������Խ���������ˮ������Ũ�ȣ���ʹƽ��������Ӧ������У��״���ת����������˽���߸÷�Ӧ��TON��B��ȷ��C������TON��ת���ļ״������ʵ���/���������ʵ�����֪��TON��״�ת�������Լ������������й�ϵ�����Ե�������������1.2��10��5 molʱ�����Ŵ������������ӣ��״���ƽ��ת���ʲ�һ������ߣ�C����ȷ��D���������ܸı�ƽ��״̬�����DMC�IJ����������ϵ��D����ȷ����ѡAB��
��4��Ka��
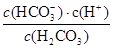 ��Ka=10-6.1mol?L-1������ѪҺ��c��HCO3-����c��H2CO3����20��1����c��H+��=10-7.4mol?L-1����pH��7.4��
��Ka=10-6.1mol?L-1������ѪҺ��c��HCO3-����c��H2CO3����20��1����c��H+��=10-7.4mol?L-1����pH��7.4����5�����ݣ�4���з�����֪��������ѪҺ�Լ��ԣ�c(OH-)��c(H+)����֪Ka��
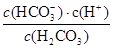 ��10-6.1��ѪҺ��ƷpHΪ7.4����c��H+��=10-7.4mol/L������
��10-6.1��ѪҺ��ƷpHΪ7.4����c��H+��=10-7.4mol/L������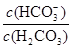 ��10?6.1��10?7.4��101.3�����ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪc(HCO3-)��c(H2CO3)��c(OH-)��c(H+)��
��10?6.1��10?7.4��101.3�����ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪc(HCO3-)��c(H2CO3)��c(OH-)��c(H+)����6��ѪҺ�д���H2CO3
 HCO3-+H+ƽ�⣬������ǿʱ��ѪҺ��������Ũ��������ƽ�������ƶ���������ǿʱ����������Ũ������ƽ�������ƶ�����˿���ά��ѪҺ��pH�ȶ���
HCO3-+H+ƽ�⣬������ǿʱ��ѪҺ��������Ũ��������ƽ�������ƶ���������ǿʱ����������Ũ������ƽ�������ƶ�����˿���ά��ѪҺ��pH�ȶ���
��ϰ��ϵ�д�
�����Ŀ
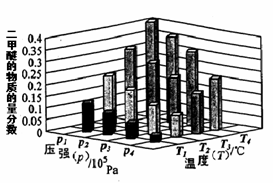
 N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol ���¶�T1��T2ʱ���ֱ�0��50 mol CH4��1��2 mol NO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±���
N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol ���¶�T1��T2ʱ���ֱ�0��50 mol CH4��1��2 mol NO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±��� CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��
CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��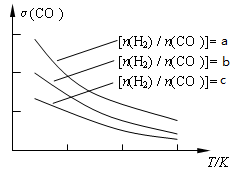
 O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺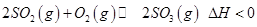 ���Ʊ��������Ҫ��Ӧ������˵����ȷ����
���Ʊ��������Ҫ��Ӧ������˵����ȷ���� ���
���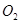
 cQ(g)������M��N��Q�����ʵ�����ʱ��ı仯��ͼ��ʾ��������������ȷ����( )
cQ(g)������M��N��Q�����ʵ�����ʱ��ı仯��ͼ��ʾ��������������ȷ����( )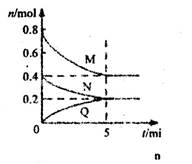
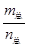 =69g/molʱ����n(NO2)��n(N2O4)=2��1��
=69g/molʱ����n(NO2)��n(N2O4)=2��1��