题目内容
【题目】已知:C(s)+O2(g) ![]() CO2(g) ΔH=-437.3 kJ·mol-1;2CO(g)+ O2(g)
CO2(g) ΔH=-437.3 kJ·mol-1;2CO(g)+ O2(g) ![]() 2CO2(g) ΔH=-566.0 kJ·mol-1
2CO2(g) ΔH=-566.0 kJ·mol-1
(1)一氧化碳的标准燃烧热ΔH为:_________
(2)碳和氧气反应生成一氧化碳的热化学方程式是:___________
(3)反应CO2(g) + C(s)![]() 2CO(g) ΔH为:_________________
2CO(g) ΔH为:_________________
(4)完全燃烧相同物质的量的C和CO,放出的热量_____多(填C或CO)
(5)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式________
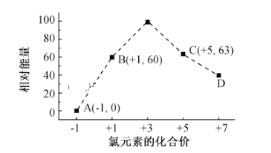
(6)一定条件下,在水溶液中1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图 所示。B→A+C反应的热化学方程式为(用离子符号表示)___________
【答案】-283kJ·mol-1 2C(s)+O2(g) ![]() 2CO(g) ΔH=-308.6 kJ·mol-1 128.7kJ·mol-1 C CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol 3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1
2CO(g) ΔH=-308.6 kJ·mol-1 128.7kJ·mol-1 C CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol 3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1
【解析】
根据燃烧热的概念及热化学方程式的含义计算燃烧热;根据盖斯定律计算反应热并书写热化学方程式;根据图示中反应物总能量与生成物总能量的相对大小计算反应热并书写热化学方程式。
(1)在25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,根据题干中的热化学方程式知,一氧化碳的标准燃烧热ΔH=![]() =283kJ·mol-1;故答案为:-283kJ·mol-1;
=283kJ·mol-1;故答案为:-283kJ·mol-1;
(2)根据盖斯定律得:I C(s)+O2(g) = CO2(g) ΔH=-437.3 kJ·mol-1;II 2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1 ,I×2-II得2C(s)+O2(g) =2CO(g) ΔH=(-437.3 kJ·mol-1)×2-(-566.0 kJ·mol-1)=-308.6 kJ·mol-1,即热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH=-308.6 kJ·mol-1,故答案为:2C(s)+O2(g) = 2CO(g) ΔH=-308.6 kJ·mol-1;
(3)根据盖斯定律得:I C(s)+O2(g) = CO2(g) ΔH=-437.3 kJ·mol-1;II 2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1 ,I-II得CO2(g) + C(s)![]() 2CO(g) ΔH=-437.3 kJ·mol-1+566.0 kJ·mol-1=128.7kJ·mol-1,故答案为:128.7kJ·mol-1;
2CO(g) ΔH=-437.3 kJ·mol-1+566.0 kJ·mol-1=128.7kJ·mol-1,故答案为:128.7kJ·mol-1;
(4)C与氧气反应生成CO时放热,CO与氧气反应生成CO2时也放热,所以完全燃烧相同物质的量的C和CO时都生成CO2,放出的热量C多,故答案为:C;
(5)8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则1molCH4燃烧时放出的热量为445.15kJ×2=890.3kJ,则热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=890.3kJ/mol,故答案为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=890.3kJ/mol;
(6)结合Cl元素的化合价可知B→A+C反应为3ClO=ClO3+2Cl,生成1molC时能量变化为3×60kJ63kJ0=117kJ,反应物总能量大于生成物总能量,该反应放出117kJ热量,热化学反应方程式为:3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1,故答案为:3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1。

 名校课堂系列答案
名校课堂系列答案