题目内容
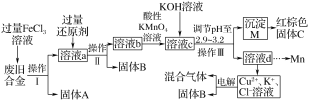
【题目】玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途____________________(答一条即可)。
【答案】过滤 Si 2Fe3++Cu===2Fe2++Cu2+ Fe3+ MnO4-+5Fe2+ +8H+===Mn2++5Fe3++4H2O Mn(OH)2 涂料等
【解析】
含有Cu、Fe、Si废旧合金中的铁与铜与过量的氯化铁溶液发生氧化还反应,得到固体硅和含氯化铜、氯化亚铁和氯化铁的混合溶液a,加入过量的还原剂铜粉,得到时氯化亚铁和氯化铜的混合溶液b,然后向溶液中加入酸性高锰酸钾将亚铁离子氧化成铁离子,得到含锰离子、铁离子和铜离子的混合溶液中滴加氢氧化钾调节溶液的pH使铁离子完全沉淀,然后过滤得到氢氧化铁固体,灼烧得到氧化铁,以此解答该题。
(1)通过操作Ⅰ、Ⅱ、Ⅲ都得到固体和溶液,所用该操作是过滤,过滤是把不溶性固体和溶液分开的操作,含有Cu、Fe、Si废旧合金中的铁与铜与过量的氯化铁溶液发生氧化还反应,得到固体硅和含氯化铜、氯化亚铁和氯化铁的混合溶液a,
故答案为:过滤;Si;
(2)合金中含有铜,可与氯化铁反应,加人过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+,
故答案为:2Fe3++Cu===2Fe2++Cu2+;
(3)因Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,溶度积常数越小,对应离子越易沉淀,所以沉淀顺序为:Fe3+>Cu2+>Mn2+,使氯化铁完全生成氢氧化铁,故答案为:Fe3+;
(4)溶液b中含亚铁离子,会被酸性高锰酸钾氧化成铁离子,高锰酸钾被还原为锰离子,反应的离子方程式为MnO4-+5Fe2+ +8H+===Mn2++5Fe3++4H2O ,
故答案为:MnO4-+5Fe2+ +8H+===Mn2++5Fe3++4H2O ;
(5)因Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,溶度积常数越小,对应离子越易沉淀,故沉淀顺序为:Fe3+>Cu2+>Mn2+,则最后得到Mn(OH)2
故答案为:Mn(OH)2;
(6)红棕色固体C是氧化铁,用途是油漆,涂料,
故答案为:涂料。

【题目】实验室中有一未知浓度的稀盐酸,请完成下列填空:
(1)配制100mL 0.10mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)___→洗涤(并将洗涤液移入容量瓶)→___→____→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________g氢氧化钠固体,所需仪器有:天平(带砝码、镊子)、_______、________。
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成后,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.64 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失