题目内容
【题目】己知浓硝酸和乙胺反应:![]() ,产物
,产物![]() 的熔点为
的熔点为![]() ,在室温下能够融化电离出
,在室温下能够融化电离出![]() 和
和![]() 离子,称为室温离子.下列有关正确的是
离子,称为室温离子.下列有关正确的是![]()
A.浓硝酸和乙胺反应属于加成反应
B.室溫离子可以使熔盐燃料电池在常溫下工作
C.![]() 中,只有
中,只有![]() 键没有
键没有![]() 键
键
D.融化![]() 晶体需要破坏分子间作用力
晶体需要破坏分子间作用力
【答案】B
【解析】
![]() 该反应生成离子化合物而不是共价化合物,且不存在不饱和键中的化学键断裂结合原子或原子团,所以应该是化合反应而不是加成反应,故A错误;
该反应生成离子化合物而不是共价化合物,且不存在不饱和键中的化学键断裂结合原子或原子团,所以应该是化合反应而不是加成反应,故A错误;
B.产物![]() 的熔点为
的熔点为![]() ,在室温下能电离出阴阳离子,所以室溫离子可以使熔盐燃料电池在常溫下工作,故B正确;
,在室温下能电离出阴阳离子,所以室溫离子可以使熔盐燃料电池在常溫下工作,故B正确;
C.![]() 中的
中的![]() 中含有
中含有![]() 键,故C错误;
键,故C错误;
D.熔融状态下,电离出阴阳离子的化合物属于离子化合物,离子化合物熔融状态下破坏离子键而不是分子间作用力,故D错误;
故选:B。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 5.0 | 3.5 | 2.5 | 2.5 |
下列说法正确的是
A. 500s内N2O5分解速率为6×10-3mol/(L·s)
B. 该温度下的平衡常数K =125
C. 反应达平衡时,吸收的热量为5Q kJ
D. 其他条件不变,若开始时c(N2O5)=10mol/L,则达平衡后c(N2O5)=5mol/L
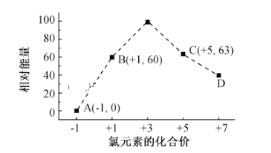
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 。请根据下表所列数据判断下列说法,其中错误的是
。请根据下表所列数据判断下列说法,其中错误的是![]()
![]()
元素 |
|
|
|
|
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X常见化合价是![]()
B.元素Y是第ⅢA族元素
C.同周期主族元素中,X的第一电离能最小
D.若元素Y处于第三周期,它可与冷水剧烈反应