题目内容
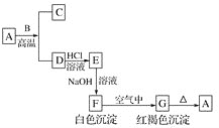
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
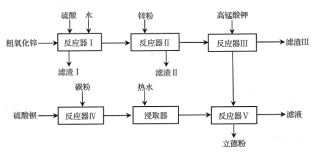
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
【答案】反应中产生氢气,达一定浓度后易爆炸,出现危险,需要通风 Zn+Cu2+= Zn2++Cu b MnO2和Fe(OH)3 避免产生CO等有毒气体 尾气中含有的SO2等有毒气体 ZnSO4、BaS、Na2S 4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4
【解析】
分析流程中的相关反应:反应器Ⅰ中粗氧化锌中所含Zn、CuO、FeO与硫酸反应,不溶性杂质以滤渣Ⅰ的形式过滤分离;反应器Ⅱ中用Zn置换溶液中Cu2+;反应器Ⅲ中用KMnO4氧化Fe2+,同时控制pH,在弱酸性、弱碱性环境中,产生MnO2和Fe(OH)3沉淀得到净化的ZnSO4溶液;反应器Ⅳ中 BaSO4 + 2C = BaS + 2CO2制备BaS;反应器Ⅴ用ZnSO4和BaS共沉淀制备立德粉。
⑴反应器Ⅰ中Zn与硫酸反应产生氢气,保持强制通风,避免氢气浓度过大而易发生爆炸,出现危险,故答案为反应中产生氢气,达一定浓度后易爆炸,出现危险,需要通风。
⑵反应器Ⅱ中用Zn置换溶液中Cu2+,其离子方程式为Cu2+,Zn+Cu2+= Zn2++Cu,故答案为Zn+Cu2+= Zn2++Cu。
⑶反应器Ⅲ除Fe2+,将亚铁离子氧化为铁离子以便除去,同时在弱酸性、弱碱性环境中KMnO4还原为MnO2,以滤渣形式分离,因此在弱酸性环境来氧化亚铁离子,利用铁离子水解变为沉淀,故答案为b;MnO2和Fe(OH)3。
4反应器Ⅳ中BaSO4 + 2C = BaS + 2CO2,BaSO4 + 4C = BaS + 4CO,投料比要大于1:2,避免产生CO等有毒气体;生产过程中会有少量氧气进入反应器Ⅳ,将BaS氧化产生SO2等有毒气体,因此有毒气体要除掉需用碱液吸收,故答案为避免产生CO等有毒气体;尾气中含有的SO2等有毒气体。
⑸已知BaSO4的相对分子质量为233,ZnS的相对分子质量为97,ZnS含量为29.4%,立德粉为BaSO4·ZnS;ZnS含量为62.5%,立德粉(BaSO4· 4ZnS),因此需要4mol ZnSO4和1mol BaS反应生成BaSO4·4ZnS,还需要3mol硫离子和将3mol硫酸根与另外的离子结合,因此还需要3mol Na2S参与反应,反应的化学方程式为:4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4,故答案为ZnSO4、BaS、Na2S;4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4。