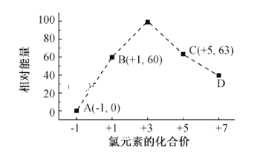
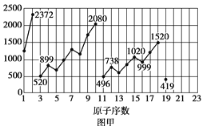
题目内容
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol·L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-,②Cr2O72-还原产物为Cr3+。
请回答下列问题:
(1)写出Cr(OH)3溶于NaOH的离子方程式___。
(2)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___。
(3)常温下,向50mL0.005mol·L1的Cr2(SO4)3溶液中加入0.24mol·L1的NaOH溶液50mL,充分反应后,溶液pH为___。
(4)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100mL滤液;
Ⅱ.用cmol·L1的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液。
①步骤Ⅱ中的滴定过程应选用___(填“酸式”或“碱式”)滴定管。
②写出步骤Ⅱ中离子反应方程___。
【答案】Cr(OH)3+OH-![]() CrO2-+2H2O 1.0×1032 13 酸式 MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
CrO2-+2H2O 1.0×1032 13 酸式 MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
【解析】
(1)NaOH过量时Cr(OH)3溶解生成CrO2-,据此书写反应的离子方程式;
(2)Cr3+完全沉淀(c≤1.0×10-5mol/L)时,溶液的pH为5,据此计算Cr(OH)3的溶度积常数;
(3)先根据方程式确定反应后的剩余量,再确定反应后的溶液pH;
(4)①步骤Ⅱ中所用的标准液为酸性高锰酸钾溶液,具有强氧化性,据此判断选择的滴定管;②KMnO4酸性溶液与FeSO4溶液发生氧化还原反应,据此书写反应的离子方程式。
(1)NaOH过量时Cr(OH)3溶解生成CrO2-,所以Cr(OH)3溶于NaOH的离子方程式为:Cr(OH)3+OH-CrO2-+2H2O,故答案为:Cr(OH)3+OH-CrO2-+2H2O;
(2)Cr3+完全沉淀(c≤1.0×10-5mol/L)时,溶液的pH为5,则溶液中c(OH-)=10-9mol/L,所以Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=1.0×10-5×(10-9)3=1.0×10-32,故答案为:1.0×10-32;
(3)发生反应为:Cr3++3OH-═Cr(OH)3,NaOH过量,过量NaOH继续溶解Cr(OH)3,Cr(OH)3+OH-CrO2-+2H2O,
Cr3+ + 3OH- ═ Cr(OH)3
0.005 0.015 0.005
Cr(OH)3 + OH- CrO2-+2H2O
0.005 0.005 0.005
所以剩余c(OH-)=![]() mol/L=0.11mol/L,所以pH=13,故答案为:13;
mol/L=0.11mol/L,所以pH=13,故答案为:13;
(4)①步骤Ⅱ中所用的标准液为酸性高锰酸钾溶液,具有强氧化性,需选用酸式滴定管,故答案为:酸式;
②步骤Ⅱ中KMnO4酸性溶液与FeSO4溶液发生氧化还原反应,反应的离子反应方程为MnO-4+5Fe2++8H+═Mn2++5Fe3++4H2O,故答案为:MnO-4+5Fe2++8H+═Mn2++5Fe3++4H2O。

 名校课堂系列答案
名校课堂系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 5.0 | 3.5 | 2.5 | 2.5 |
下列说法正确的是
A. 500s内N2O5分解速率为6×10-3mol/(L·s)
B. 该温度下的平衡常数K =125
C. 反应达平衡时,吸收的热量为5Q kJ
D. 其他条件不变,若开始时c(N2O5)=10mol/L,则达平衡后c(N2O5)=5mol/L
【题目】下列说法中正确的是( )
A.HF、HCl、![]() 、
、![]() 的稳定性依次增强
的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能![]() 数据如下表所示
数据如下表所示![]() 单位:
单位:![]() ,可推测该元素位于元素周期表第ⅤA族
,可推测该元素位于元素周期表第ⅤA族
I | I | I | I | I | I | I |
578 |
|
|
|
|
|
|
D.在①P、S,②![]() 、Ca,③
、Ca,③![]() 、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 。请根据下表所列数据判断下列说法,其中错误的是
。请根据下表所列数据判断下列说法,其中错误的是![]()
![]()
元素 |
|
|
|
|
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X常见化合价是![]()
B.元素Y是第ⅢA族元素
C.同周期主族元素中,X的第一电离能最小
D.若元素Y处于第三周期,它可与冷水剧烈反应