题目内容
【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)
【答案】 NO3—,SO42- Ba2+ 3Fe2++ NO3—+4H+ =3Fe2+NO↑+2H2O AlO2-+CO2+2H2O= Al(OH)3↓+HCO3- 3≤pH≤4
【解析】本题主要考查离子的检验。
Ⅰ.红棕色气体是二氧化氮,废水含有NO3-和还原性离子Fe2+、S2-中的一种;
Ⅲ.红褐色沉淀是氢氧化铁,表明废水含有铁元素的离子,白色絮状沉淀是氢氧化铝,表明废水含有Al3+。相应地不含有与Fe3+或Fe2+或Al3+发生反应的S2-、CO32-。
Ⅱ.白色沉淀是硫酸钡,废水含有SO42-。相应地不含有与SO42-发生反应的Ba2+。
(1)该废水中一定含有的阴离子是NO3-、SO42-,一定不含有的阳离子是Ba2+;
(2)Ⅰ中产生无色气体的反应是稀硝酸与Fe2+的反应,反应的离子方程式:3Fe2++NO3-+4H+=3Fe2+NO↑+2H2O;
(3)Ⅲ中通入过量CO2产生白色絮状沉淀,同时生成碳酸氢钠,所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)要想使Fe3+完全沉淀就是控制c(Fe3+)≤1.0×10-5mol·L-1,则要求c(OH-)≥(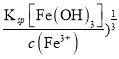 =1.0×10-11mol·L-1,pH≥3,Al3+不沉淀,c(Al3+)=1.0×10-3mol·L-1,则要求c(OH-)≤(
=1.0×10-11mol·L-1,pH≥3,Al3+不沉淀,c(Al3+)=1.0×10-3mol·L-1,则要求c(OH-)≤(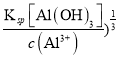 =1.0×10-10mol·L-1,pH≤4,总之,应调节溶液pH范围为3≤pH≤4。
=1.0×10-10mol·L-1,pH≤4,总之,应调节溶液pH范围为3≤pH≤4。