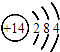题目内容
【题目】A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电,试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)写出A、B元素形成化合物电子式:___________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________个阴离子;晶体中阴、阳离子数之比为 ________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________(填“高”或“低”),其判断的理由是 ____________________________________________。
【答案】 Mg O ![]() 6 1∶1 高 离子半径相差不大,MgO中离子所带电荷数较多,离子键强,晶格能大。
6 1∶1 高 离子半径相差不大,MgO中离子所带电荷数较多,离子键强,晶格能大。
【解析】A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电,说明是离子化合物,所以首先从B原子的最外层电子数为A原子最外层电子数的3倍,B的最外层电子数<8,又是3的倍数,就只能是6,短周期元素中只有O和S,而A的最外层电子数是2,A的原子序数大于B,B只能是O,A是Mg。
⑴.根据上述分析可知,A、B分别是Mg和O,故答案是Mg、O;
⑵.A、B元素形成的化合物是MgO,其电子式为![]() ,故答案是:
,故答案是:![]() ;
;
⑶. 因A、B所形成的化合物是MgO,其晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了6个阴离子,晶体中阴、阳离子数之比为1:1,故答案为:6;1:1;
⑷.Mg2+、O2-与对应的Na+、F-半径相差不大,但Mg2+、O2-所带的电荷数多,形成的离子键较强,晶格能大,故熔点较高,因此答案是:高;离子半径相差不大,MgO中离子所带电荷数较多,离子键强,晶格能大。

【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)