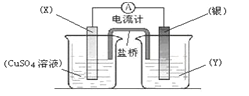
题目内容
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
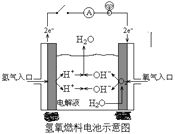
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
【答案】 Pb -2e- + SO42- = PbSO4 增大 0.5mol Pb H2 H2 -2e- + 2OH- =2H2O O2 + 4e- + 2H2O = 4OH- H2 – 2e- = 2H+ O2 + 4H+ + 4e- = 2H2O
【解析】(1)①因为放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O,Pb失电子发生负极反应,产生的Pb2+在H2SO4溶液中结合SO42-生成难溶于水的PbSO4,故其负极反应式为:Pb -2e- + SO42- = PbSO4;②根据电池反应式知,硫酸参加反应,且反应中生成水,导致溶液中氢离子浓度减小,则溶液的pH增大;根据反应Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O,转移2mol电子时,消耗2mol H2SO4,当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为0.5mol;③ 放电完后,对该电池进行充电,在连接电源的负极一端是阴极,阴极发生的电极反应式为:PbSO4 +2e- = Pb + SO42-,则阴极上生成Pb;
(2)① 则负极通入的是H2,碱性条件下氢气失去电子生成的氢离子与氢氧根离子结合生成水,则负极电极反应式为:H2 -2e- + 2OH- =2H2O;正极氧气得电子产生氢氧根离子,电极反应式为:O2 + 4e- + 2H2O = 4OH-;②如把导电介质改为稀H2SO4,酸性条件下氢气在负极失电子产生氢离子,电极反应式为:H2 – 2e- = 2H+;氧气在正极得电子产生的氢氧根离子与氢离子结合生成水,电极反应式为:O2 + 4H+ + 4e- = 2H2O。

【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)