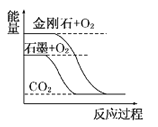
��Ŀ����
����Ŀ��������ͭˮ��Һ����μ��백ˮ�����γ���ɫ�����������μӰ�ˮ�������ܽ⣬�õ�����ɫ������Һ��������Һ�м����Ҵ�������ɫ���壨��ѧʽΪ[Cu(NH3)4]SO4��H2O��������
(1)ͭԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_________________��ͭ���ʾ����е�ԭ��ѻ�ģ������_________�ѻ�����ѻ�ģ�����ƣ���
(2)����������ɫ����������ӵ����幹����_________�������ӵ�����ԭ�ӵ��ӻ���ʽΪ_________��
(3)���ķе�����(PH2)��ԭ����_____________��
(4)Cu��һ���Ȼ��ᄃ���ṹ����ͼ��ʾ�����Ȼ���Ļ�ѧʽ��______________�����þ�����ܶ�Ϊpg��cm-3����NA��ʾ����٤����������þ����ı߳�Ϊa=_____________nm��(3��)
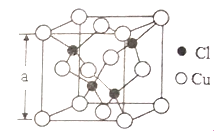
���𰸡� 1s22s22p63s23p63d104s1�� 3d104s1 �����������ܶѻ� �������� sp3 ���Ӽ���������좷��Ӽ䲻���������ֻ���ڷ��»������ʰ��ķе����좵ķе� CuCl ![]()
![]()
����������1��ͭԪ�ص�ԭ��������29����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar] 3d104s1��ͭ���ʾ����е�ԭ�Ӷѻ�ģ�����������������ܶѻ��ѻ�����2���þ����е�����������������ӣ�����ԭ��Sԭ�ӵļ۲���Ӷ�����4���Ҳ����ڹ¶Ե��ӣ����������幹�����������壬�����ӵ�����ԭ�ӵ��ӻ���ʽΪ sp3����3�����Ӽ���������좷��Ӽ䲻���������ֻ���ڷ��»������ʰ��ķе����좵ķе㣻��4����������ԭ�ӵĸ�����4����ͭԭ�ӵĸ�����8��1/8+6��1/2��4�����Ի�ѧʽΪCuCl������m��V�ѿ�֪a3p��![]() �����a��
�����a�� ��
�� nm��
nm��

����Ŀ��ij��ҵ��ˮ�п��ܺ������¼����������ӣ�
������ | Fe3+��Al3+��Fe2+��Ba2+��Na+ |
������ | Cl����CO32����NO3����SO42����S2�� |
�ֶԸ÷�ˮ��Ʒ���������о���
�����Թ��еμ�Ũ���ᣬ����������ɫ�������ɣ�����������������Ϊ����ɫ��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɡ�
����������õ���Һ�м��������NaOH��Һ���к��ɫ�������ɡ����˺���������Һ��ͨ�������CO2���壬�а�ɫ��״�������ɡ�
��������ʵ�飬�ش��������⣺
��1���÷�ˮ��һ�����е��������� _____��һ�������е���������_____��
��2��д�����в�����ɫ����ķ�Ӧ�����ӷ���ʽ��______��
��3��д������ͨ�����CO2������ɫ��״�����������ķ�Ӧ���ӷ���ʽ��______��
��4���ڷ�ˮ�м���������ˮ�������Һ��c(Fe3+)��1.0��10��2mol��L��1��c(Al3+)��1.0��10��3mol��L��1��Ҫ��ʹFe3+��ȫ����������Ũ��Ϊ1.0��10��5mol��L��1����Al 3+����������Ӧ������ҺpH��ΧΪ______������֪������Fe(OH)3��Ksp��1.0��10��38��Al(OH)3��Ksp��1.0��10��33��