��Ŀ����
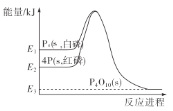
����Ŀ��Ǧ���仯������������ء������豸��X���߷������ϣ���֪Pb�Ļ��ϼ�ֻ��0��+2��+4���ش��������⣺
��1��PbO2��PbO�Ļ�����У�Pb��O�����ʵ���֮��Ϊ8��11���������У�PbO2��PbO�����ʵ���֮��Ϊ_____��
��2����������CO��ԭ13.7gijǦ����������ɵ�CO2ȫ��ͨ�뵽�����ij���ʯ��ˮ�У��õ��ij������������Ϊ8.0g�����Ǧ������Ļ�ѧʽ�ɱ�ʾΪ_____��
���𰸡�3��5 Pb3O4
��������
��1����������PbO2��PbO�����ʵ����ֱ�Ϊxmol��ymol����x+y������2x+y����8��11����֮��x��y��3��5��
�ʴ�Ϊ3��5��
��2���������������8.0gΪ̼���������
����̼��Ƶ����ʵ���Ϊ��![]() ��0.08mol��
��0.08mol��
Ǧ�������е���ԭ�ӱ�CO��ȡ����CO2��
����̼Ԫ�ء���Ԫ���غ��֪CO������O������CO2������CaCO3��
1 1 1
0.08mol 0.08mol 0.08mol
Ǧ�������е���ԭ�ӵ����ʵ���Ϊ0.08mol����Ԫ�ص�����Ϊ��0.08mol��16g/mol��1.28g��Ǧ�������е�ǦԪ�ص�����Ϊ��13.7g��1.28g��12.42g��Ǧԭ�ӵ����ʵ���Ϊ��![]() ��0.06mol��
��0.06mol��
��Ǧ��������Ǧԭ������ԭ�ӵ����ʵ���֮�ȣ�0.06mol��0.08mol��3��4��
��Ǧ������Ļ�ѧʽΪPb3O4��
�ʴ�Ϊ��Pb3O4��

����Ŀ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2������)Ϊ��Ҫԭ����������ԭ�Ϻ췯��(��Ҫ�ɷ�Na2Cr2O7��2H2O)������Ҫ�����������£�
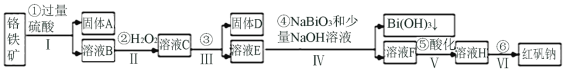
�������ϵ�֪��
���������£�NaBiO3������ˮ����ǿ�����ԣ��ڼ��������£��ܽ�Cr3+ת��Ϊ![]() ��
��
����
�������� | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
��ʼ������pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
������ȫ��pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
�ش��������⣺
(1)Fe��Ԫ�����ڱ��е�λ��______________________________����Ӧ֮ǰ�Ƚ���ʯ�����Ŀ����__________________��
(2)����ۼӵ��Լ�Ϊ_____________����ʱ��ҺpHҪ����5��Ŀ��______________��
(3)д����Ӧ�ܵ����ӷ�Ӧ����ʽ______________________��
(4)�����ữ��ʹ![]() ת��Ϊ
ת��Ϊ![]() ��д���÷�Ӧ�����ӷ���ʽ_________________��
��д���÷�Ӧ�����ӷ���ʽ_________________��
(5)����ҺH��������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ����T�ú췯�ƴ־��壬���ƺ췯����Դ־�����Ҫ���õIJ�����__________________(���������)��
����Ŀ���� 3 �������Ϊ 2.0 L �ĺ����ܱ������У���ӦH2O(g) + C(s)![]() CO(g) + H2(g) ��H > 0�ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
CO(g) + H2(g) ��H > 0�ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
���� | �¶� ��T1>T2�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.5 | 1 | 0 | 0 | 0.25 |
II | T1 | 1 | 1 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.5 | 0.5 | y |
A.���¶�Ϊ T1ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��ֵΪ 0.25
B.�� 5min ������ I �дﵽƽ�⣬�� 5min �ڵ�ƽ����Ӧ���ʣ�v(H2) = 0.05mol��L-1��min-1
C.�ﵽƽ��ʱ������ II ��H2O��ת���ʱ����� I �е�С
D.�ﵽƽ��ʱ������ III �е� CO ��ת����С�� 50%
����Ŀ�����Ĺ̶�һֱ�ǿ�ѧ���о�����Ҫ���⣬�ϳɰ������˹��̵��Ƚϳ���ļ�������ԭ��ΪN2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)��֪ÿ�ƻ�1mol�йػ�ѧ����Ҫ���������±���
H-H | N-H | N-N | N��N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)��Ӧ���������_________(����>���� ��<��)�������������
(2)��һ���¶��¡���2L�ܱ������м���2 molN2��6 mol H2�����ʵ��Ĵ��������£�������Ӧ N2 (g)+3H2 (g)![]() 2NH3(g)��10min��ﵽƽ�⣬��ʱʣ��4.5mol H2��
2NH3(g)��10min��ﵽƽ�⣬��ʱʣ��4.5mol H2��
������������˵���˷�Ӧ�ﵽƽ��״̬����________________________��
a����������ѹǿ���� b��v(H2)����v(H2)���� c��N2��H2��Ũ�����
d�� 2 mol NH3���ɵ�ͬʱ��3 moH��H������ e��NH3��Ũ�Ȳ��ٸı�
��0��10 min�ڵ�ƽ����Ӧ����v(H2) ��______mol/(Lmin)��10��ĩNH3��Ũ����______mol/L��N2 �ĵ����ʵ���________mol
��ij�¶�ʱ����һ��2L���ܱ�������X��Y��Z�����������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ���ݴ˻ش�
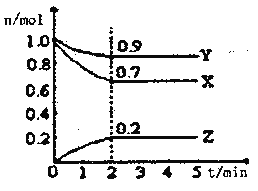
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ_______________________
(2)�ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ____________mol/(L��min)��
(3)�ı��������������Լӿ컯ѧ��Ӧ���ʵ���_________
A�������¶� B����С����X�����ʵ���
C����Сѹǿ D����������Z�����ʵ���.
E������ij�ִ��� F.��С�ݻ� G��ʹ��Ч�ʸ��ߵĴ���
(4)�÷�Ӧ����Ϊ���ȷ�Ӧ����������Ϊ��������(��������Ƚ���)����ƽ������ʱ�佫_________��
a���ӳ� b������ c������ d����ȷ��