题目内容
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
【答案】8 mol 5 mol 
【解析】
反应生成Cl2在标准状况下体积为56L,根据n=V/Vm计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析被氧化的HCl的量,双线桥标出电子转移的情况。
(1)56LCl2在标况下的物质的量为n=V/Vm=56/22.4=2.5mol,则参加反应的HCl的物质的量为2.5mol×16/5=8mol;
综上所述,本题答案是:8mol。
(2)反应中16molHCl只有10mol被氧化,即被氧化的HCl占总的HCl物质的量5/8,根据反应关系:10molHCl(被氧化)----5molCl2,现有2.5molCl2生成,所以反应中被氧化的HCl的物质的量为5mol;
综上所述,本题答案是:5mol。
(3)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e﹣,电子的转移方向和数目为: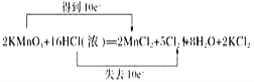 ;
;
综上所述,本题答案是: 。
。

练习册系列答案
相关题目

