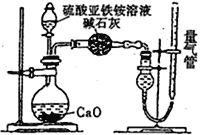
题目内容
【题目】元素B是第三周期的主族元素,B在周期表中与邻近的元素A、C、D、E的位置如图所示,已知该五种元素的核电荷数之和为85,回答下列问题:
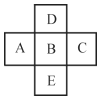
(1)B元素的原子序数是_____,原子结构示意图是_____。
(2)A、B、C三种元素的非金属性由强到弱的顺序是_____,它们的最高价氧化物的水化物的酸性由弱到强的顺序是_____。(用化学式表示)
(3)B、D、E三种元素的非金属性由强到弱的顺序是_____,它们的氢化物的还原性由弱到强的顺序是_____(用化学式表示)
【答案】15  S>P>Si H2SiO3<H3PO4<H2SO4 N>P>As NH3<PH3<AsH3
S>P>Si H2SiO3<H3PO4<H2SO4 N>P>As NH3<PH3<AsH3
【解析】
元素B是第三周期的主族元素,B在周期表中与邻近的元素A、C、D、E的位置如图所示,AC为第三周期元素,D为第二周期元素,E为第四周期元素,已知该五种元素的核电荷数之和为85,设B核电荷数x,则A为x﹣1,C为x+1,D为x﹣8,E为x+18,x+18+x+x﹣1+x+1+x﹣8=85,x=15,判断ABCDE分别为:Si、P、S、N、As,
(1)B为磷,是15号元素,原子核外三个电子层,最外层5个电子,原子结构示意图是: ,
,
故答案为:15; ;
;
(2)同周期非金属性增强,最高价氧化物的水化物的酸性增强,A、B、C三种元素的非金属性由强到弱的顺序是:S>P>Si,它们的最高价氧化物的水化物的酸性由弱到强的顺序是:H2SiO3<H3PO4<H2SO4,
故答案为:S>P>Si;H2SiO3<H3PO4<H2SO4;
(3)B、D、E三种元素为同主族元素,非金属性减弱,得到电子能力减弱,B、D、E三种元素的非金属性由强到弱的顺序是:N>P>As,氢化物稳定性减弱,它们的氢化物的还原性由弱到强的顺序是NH3<PH3<AsH3,
故答案为:N>P>As;NH3<PH3<AsH3。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案