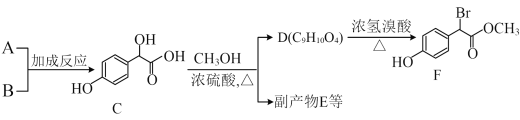
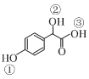
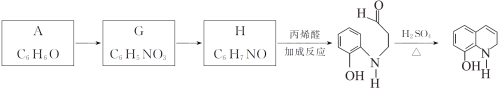
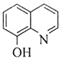
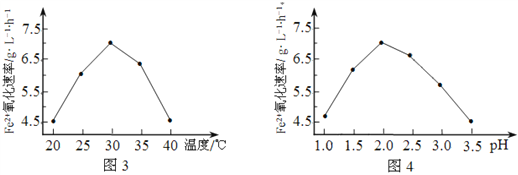
题目内容
【题目】常温下,将NH3通入50 mL NH4Cl溶液中至pH=10,再向其中滴加1 mol/L盐酸。溶液的pH随加入盐酸体积的变化如下图所示。

下列说法不正确的是
A.a点溶液中,c(OH-)=l×l0-4 mol/LB.b点溶液中,c(NH4+)>c(Cl-)
C.c点时,加入的n(HCI)小于通入的n(NH3)D.a→b,水的电离程度减小
【答案】D
【解析】
A.a点溶液PH=10,c(H+)=1×10-10 mol/L c(OH-)= ![]() =l×l0-4 mol/L,A项正确;
=l×l0-4 mol/L,A项正确;
B.b点溶液呈碱性,根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知c(H+)<c(OH-) 则有c(NH4+)>c(Cl-),B项正确;
C.由图可知c点对应PH值大于8,c点溶液还是呈碱性,说明加入的n(HCl)小于通入的n(NH3),C项正确;
D.a→b,碱性变弱,水电电离受到的抑制逐渐变弱,所以水的电离程度增大,D项错误;
答案选D。

【题目】请用C、H、O、N、S五种元素回答下列问题
(1)除H外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________,电负性最大的元素基态原子核外电子运动状态共有_________种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①1mol乙分子含有_________个σ键;
②丁分子的中心原子采取_________杂化方式;甲分子的VSEPR模型为_________,丙分子为_________(“极性”或“非极性”)分子。