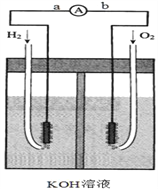
题目内容
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
【答案】D
【解析】半分钟后NO的物质的量增加了0.3mol,所以△c(NO)=0.3mol/5L=0.06mol·L-1,所以v(NO)═0.06mol·L-1/30s=0.002mol/(L·s),
A、v(O2)=5v(NO)/4═1.25×0.002mol/(L·s)=0.0025mol/(L·s)故A错误;B、v(NO)═0.06mol·L-1/30s=0.002mol/(L·s),故B错误;C、v(H2O)=6v(NO)/4═1.5×0.002mol/(L·s)=0.003mol/(L·s),故C错误;D、氨气与NO的化学计量数相同,化学反应速率之比等于化学计量数之比,故v(NH3)=0.002mol·(L·s) –1,故D正确;故选D。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______(填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______。
(2)合成氨的反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
化学键 | H—H | N≡N | N—H |
E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=_______kJ/mol,低温下,合成氨反应_______(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H = _______kJ/mol
2NO(g) △H = _______kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______(只列算式不计算)。