题目内容
【题目】(一)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
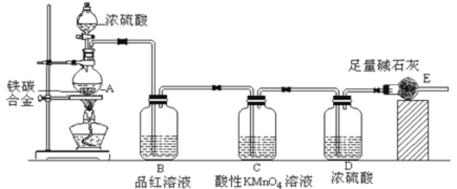
(1)仪器A的名称是___________。
(2)C装置的作用______________。
(3)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是___________。
A.A中反应不完全
B.反应生成的SO2部分被E中碱石灰吸收
C.E中碱石灰会吸收空气中的CO2和H2O
D.反应完全后,还有CO2气体滞留在装置体系中
(二)将19.20 g CuO和Fe2O3的混合物在高温下与足量的CO充分反应,反应后全部气体用200 mL 1.20 molL-1 Ba(OH)2溶液吸收,生成35.46 g白色沉淀(不考虑沉淀的溶解,忽略溶液体积的变化)。
(4)则吸收气体后溶液中溶质的化学式为________,其浓度为_________。
(5)混合物中CuO和Fe2O3的物质的量之比为__________。
【答案】圆底烧瓶 除尽反应生成的二氧化硫 BC Ba(HCO3)2 0.3 molL-1 2:1
【解析】
(一)由装置图可知,实验原理是通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数。故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥。
(二) CuO和Fe2O3的混合物在高温下与足量的CO充分反应生成CO2,少量CO2与Ba(OH)2反应生成BaCO3,过量的CO2再与与BaCO3反应生成Ba(HCO3)2,依据反应的化学方程式解题即可。
(1)仪器A为圆底烧瓶。
(2)C中酸性高锰酸钾可以和SO2发生反应,因此C装置是为了除尽SO2,避免影响对CO2的测定。
(3)A.A中反应不完全,导致测定的CO2的质量减少,铁的质量分数增大,故A错误。
B.反应生成的SO2部分被E中碱石灰吸收,导致测定的CO2的质量增大,铁的质量分数减小,故B正确。
C.E中碱石灰会吸收空气中的CO2和H2O,导致测定的CO2的质量增大,铁的质量分数减小,故C正确。
D.装置中残留的CO2没有完全被E吸收,导致测定的CO2的质量减少,铁的质量分数增大,故D错误。本题选BC。
(二) (4)发生反应为CO2+Ba(OH)2=BaCO3↓+H2O①、CO2+H2O+BaCO3=Ba(HCO3)2②。生成35.46 g白色沉淀BaCO3,根据化学方程式①可求得参加反应①的n1[Ba(OH)2]=n(BaCO3)=![]() =0.18mol,参与反应②的n2[Ba(OH)2]=0.2 L×1.20 molL-1-0.18mol =0.06 mol,根据化学方程式②列比例式可得n[Ba (HCO3)2]=0.06 mol,c[Ba (HCO3)2]=
=0.18mol,参与反应②的n2[Ba(OH)2]=0.2 L×1.20 molL-1-0.18mol =0.06 mol,根据化学方程式②列比例式可得n[Ba (HCO3)2]=0.06 mol,c[Ba (HCO3)2]=![]() =0.3 mol/L。吸收后溶液的溶质为Ba (HCO3)2。
=0.3 mol/L。吸收后溶液的溶质为Ba (HCO3)2。
(5)参与反应①的n1(CO2)= n1[Ba(OH)2]=0.18mol,参与反应②的n2(CO2)= n2[Ba(OH)2]+ n2(BaCO3)=0.12mol,因为生成的CO2全部参与了反应,n(CO2)= 0.18mol+0.12mol=0.3mol。设CuO和Fe2O3的物质的量分别为x mol、y mol,根据化学方程式CuO+CO![]() Cu+CO2、Fe2O3+3CO
Cu+CO2、Fe2O3+3CO![]() 2Fe+3CO2,列方程组80x+160y=19.2①,x+3y=0.3②,解得x=0.12 mol,y=0.06 mol。CuO和Fe2O3的物质的量之比为2∶1。
2Fe+3CO2,列方程组80x+160y=19.2①,x+3y=0.3②,解得x=0.12 mol,y=0.06 mol。CuO和Fe2O3的物质的量之比为2∶1。

 阅读快车系列答案
阅读快车系列答案【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:
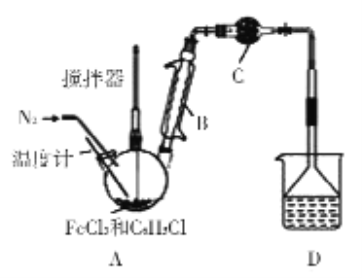
(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________