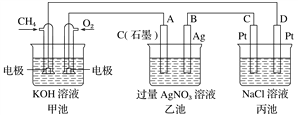
题目内容
【题目】向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,请计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和原溶液中溶质的物质的量浓度。
(3)在标准状况下生成H2的体积。
【答案】(1)0.4 mol(2)0.8 mol·L-1(3)13.44 L
【解析】
试题(1)根据n=![]() 计算Al的物质的量;
计算Al的物质的量;
(2)发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式计算NaOH的物质的量,根据c=![]() 计算其物质的量浓度;
计算其物质的量浓度;
(3)根据方程式计算氢气的物质的量,再根据V=nVm计算其体积.
解:(1)10.8gAl的物质的量为:![]() =0.4mol,
=0.4mol,
答:10.8gAl的物质的量为0.4mol;
(2)设参加反应的NaOH的物质的量为x mol,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 2
0.4mol xmol
则:2:2=0.4mol:x mol,解得:x=0.4,
故NaOH溶液的物质的量浓度为:![]() =0.8mol/L,
=0.8mol/L,
答:参加反应的NaOH的物质的量为0.4mol,NaOH溶液的物质的量浓度为0.8mol/L;
(3)设生成氢气的物质的量为y mol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.4mol ymol
则:2:3=0.4mol:y mol,解得:y=0.6,
所以生成氢气在标准状况下的体积为:0.6mol×22.4L/mol=13.44L,
答:生成氢气的体积为13.44L.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-
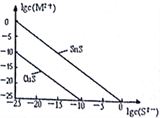
①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。