题目内容
【题目】合成氨厂和硝酸厂的烟气中含有大量的氮氧化物(NOx),脱硝通常是指将烟气中的氮氧化物转化为无毒无害的物质的化学过程。
(1)选择性催化还原技术(SCR)是目前最成熟的脱硝技术,即在金属催化剂的作用下,用还原剂(如NH3)选择性的与NOx反应生成N2和H2O。
已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)2NO(g) △H=+180kJmol-1
脱硝反应:4NH3(g)+6NO(g)5N2(g)+6H2O(g)的△H=_______kJmol-1
(2)将amolN2和3amolH2通入一密闭容器中在不同的温度和压强下发生反应:N2(g)+3H2(g)2NH3(g)。测得平衡体系中NH3的物质的量的分数如图所示。
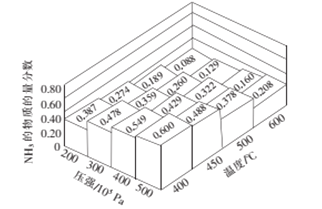
①下列可提高氨气产率的途径是__________。
A.尽量提高反应温度 B.对原料气适当加压
C.采用适当的催化剂 D.将氨气液化,不断移出液氨
②上图所示平衡体系中当NH3的物质的量分数分别为0.549和0.429时,该反应的平衡常数分别为K1和K2,则K1________K2(填写“>”,“<”或“=”)。当NH3的物质的量分数为0.600时,容器的体积为2L,此时该反应的化学平衡常数K=________。
(3)常温下,将NO和H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中其物质转化过程如图所示,
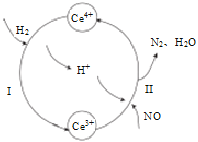
①反应I中氧化剂与还原剂的物质的量之比为_______。
②写出该过程的总化学反应方程式_____________________________________。
(4)直接电解吸收也是脱硝的一种方法,先用6%的稀硝酸吸收NOx,会生成HNO2(一种一元弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,其电解装置如图所示。
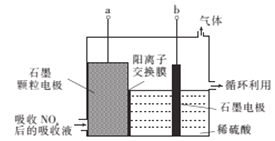
①图中b应连接电源的_______(“正极”或“负极”)。
②阳极的电极反应式为___________________。
【答案】 -1805.5 BD > 256/3a2 2:1 2H2+2NO![]() N2+2H2O 负极 H2O+HNO2-2e-=NO3-+3H+
N2+2H2O 负极 H2O+HNO2-2e-=NO3-+3H+
【解析】分析:本题考查盖斯定律的应用、化学平衡图像的分析、化学平衡常数的计算、氧化还原反应的分析、电解原理的应用。
(1)将两个反应依次编号为①式、②式,应用应用盖斯定律,①式-②式![]() 5消去O2。
5消去O2。
(2)采用“定一议二”法分析图像,得出反应N2(g)+3H2(g)![]() 2NH3(g)的特点:正反应为气体分子数减小的放热反应。
2NH3(g)的特点:正反应为气体分子数减小的放热反应。
①根据勒夏特列原理,判断改变条件后平衡移动的方向。
②该反应的正反应为放热反应,升高温度化学平衡常数减小。用三段式和化学平衡常数表达式计算化学平衡常数。
(3)根据图示确定反应物和生成物,对照氧化还原反应的基本概念、运用电子守恒。将反应I和反应II相加消去过程物质得总反应方程式。
(4)HNO2转化为HNO3为氧化反应,电解时氧化反应在阳极发生,图中a为阳极,b为阴极。
详解:(1)将反应编号,
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH=-905.5kJ·mol-1(①式)
4NO(g)+6H2O(g)ΔH=-905.5kJ·mol-1(①式)
N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1(②式)
2NO(g) ΔH=+180kJ·mol-1(②式)
应用盖斯定律,①式-②式![]() 5得,4NH3(g)+6NO(g)
5得,4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)ΔH=(-905.5kJ/mol)-(+180kJ/mol)
5N2(g)+6H2O(g)ΔH=(-905.5kJ/mol)-(+180kJ/mol)![]() 5=-1805.5kJ/mol。
5=-1805.5kJ/mol。
(2)根据图像,在相同压强下升高温度,NH3的物质的量分数减小,平衡向逆反应方向移动,反应N2(g)+3H2(g)![]() 2NH3(g)的正反应是放热反应。
2NH3(g)的正反应是放热反应。
①A项,尽量提高反应温度,平衡向逆反应方向移动,NH3的产率减小;B项,对原料气适当加压,平衡向正反应方向移动,NH3的产率增大;C项,采用适当的催化剂,平衡不移动,NH3的产率不变;D项,将NH3液化,不断移出液氨,平衡向正反应方向移动,NH3的产率增大;可提高NH3产率的途径是BD,答案选BD。
②根据图像,NH3的物质的量分数分别为0.549和0.429时,压强相同、温度分别为400℃和450℃,升高温度平衡向逆反应方向移动,NH3物质的量分数减小,K值减小,K1![]() K2。设转化N2物质的量为xmol,用三段式
K2。设转化N2物质的量为xmol,用三段式
N2(g) + 3H2(g)![]() span>2NH3(g)
span>2NH3(g)
n(起始)(mol)a 3a 0
n(转化)(mol)x 3x 2x
n(平衡)(mol)a-x 3a-3x 2x
平衡时NH3物质的量分数为0.600, ![]() =0.600,解得x=0.75a,平衡时N2、H2、NH3物质的量依次为0.25amol、0.75amol、1.5amol,容器的体积为2L,平衡时N2、H2、NH3物质的量浓度依次为0.125amol/L、0.375amol/L、0.75amol/L,此反应的平衡常数K=
=0.600,解得x=0.75a,平衡时N2、H2、NH3物质的量依次为0.25amol、0.75amol、1.5amol,容器的体积为2L,平衡时N2、H2、NH3物质的量浓度依次为0.125amol/L、0.375amol/L、0.75amol/L,此反应的平衡常数K=![]() =
=![]() =
=![]() 。
。
(3)①根据图示,反应I为Ce4++H2→Ce3++H+,反应中Ce元素的化合价由+4价降至+3价,Ce4+为氧化剂,H元素的化合价由0价升至+1价,H2为还原剂,根据得失电子守恒,n(Ce4+)=2n(H2),n(Ce4+):n(H2)=2:1,反应I中氧化剂与还原剂物质的量之比为2:1。
②根据图示反应I为:2Ce4++H2=2Ce3++2H+,反应II为:4Ce3++2NO+4H+=4Ce4++N2+2H2O,将反应I和反应II相加消去Ce4+、Ce3+,总反应为2H2+2NO![]() 2H2O+N2。
2H2O+N2。
(4)①根据题意,电解过程中HNO2转化为HNO3,HNO2被氧化成HNO3,电解时氧化反应在阳极发生,图中a为阳极,b为阴极,阴极与外加电源的负极相连,b应连接电源的负极。
②阳极HNO2失电子生成HNO3,阳极电极反应式为:HNO2-2e-+H2O=NO3-+3H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:

(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________