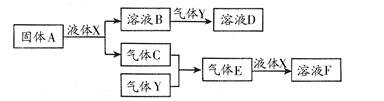
题目内容
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式 。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为 。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式 。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为 。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
(1)NH3
(2)H2O2+OH-=HO2-+H2O HO2-+OH-=H2O+O22- (或H2O2+2OH-=O22-+2H2O)
(3)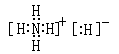
(4)NH4NO2+AgNO3=AgNO2↓+NH4NO3 c(NO2-)>c(NH4+)>c(H+)>c(OH-)
(5)HS-+OH-=S2-+H2O
(2)H2O2+OH-=HO2-+H2O HO2-+OH-=H2O+O22- (或H2O2+2OH-=O22-+2H2O)
(3)
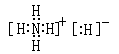
(4)NH4NO2+AgNO3=AgNO2↓+NH4NO3 c(NO2-)>c(NH4+)>c(H+)>c(OH-)
(5)HS-+OH-=S2-+H2O
根据元素的结构及有关性质可知,A、B、C、D、E五种元素分别是H、N、O、Na、S。
(1)NH3的沸点比H2S的要高。
(2)过氧化氢可以看作是二元弱酸,所以和氢氧化钠反应的方程式为H2O2+2OH-=O22-+2H2O。
(3)H和N要形成离子化合物,则只能是氢化铵,其电子式为
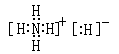
(4)硝酸银易溶于水,所以白色沉淀应该是亚硝酸银,方程式为NH4NO2+AgNO3=AgNO2↓+NH4NO3;溶液显酸性,说明NH4+的水解程度大于NO2-的水解程度,所以离子浓度大小顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-)。
(5)根据XY的性质及组成结构特点可知,X是NaOH,Y是NaHS,二者反应的方程式为HS-+OH-=S2-+H2O。
(1)NH3的沸点比H2S的要高。
(2)过氧化氢可以看作是二元弱酸,所以和氢氧化钠反应的方程式为H2O2+2OH-=O22-+2H2O。
(3)H和N要形成离子化合物,则只能是氢化铵,其电子式为
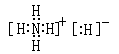
(4)硝酸银易溶于水,所以白色沉淀应该是亚硝酸银,方程式为NH4NO2+AgNO3=AgNO2↓+NH4NO3;溶液显酸性,说明NH4+的水解程度大于NO2-的水解程度,所以离子浓度大小顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-)。
(5)根据XY的性质及组成结构特点可知,X是NaOH,Y是NaHS,二者反应的方程式为HS-+OH-=S2-+H2O。

练习册系列答案
相关题目



 族
族