题目内容
(14分)下表为元素周期表的一部分:
Ⅰ.用化学用语回答下列问题:
(1)写出元素④在周期表中的位置: ;
(2)②③⑤的原子半径由大到小的顺序为 ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化
合物的电子式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:
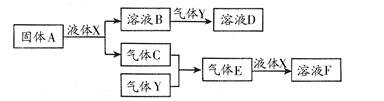
(1)写出固体A与液体X反应的离子方程式: ;
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
 族 族周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
(1)写出元素④在周期表中的位置: ;
(2)②③⑤的原子半径由大到小的顺序为 ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化
合物的电子式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:

(1)写出固体A与液体X反应的离子方程式: ;
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
(14分)
Ⅰ.⑴第三周期ⅣA族;(1分) ⑵ Na>S>O ;(2分)
⑶ HCl>H2S>SiH4 ;(2分) ⑷ Na+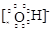 、
、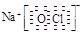 ;(2分)
;(2分)
Ⅱ.⑴ 2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;(2分)
⑵ NaHSO3;(1分) c(Na+)>c(HSO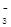 )>c(H+)>c(SO
)>c(H+)>c(SO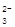 )>c(OH-) ;(2分)
)>c(OH-) ;(2分)
⑶ D 。(2分)
Ⅰ.⑴第三周期ⅣA族;(1分) ⑵ Na>S>O ;(2分)
⑶ HCl>H2S>SiH4 ;(2分) ⑷ Na+
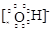 、
、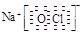 ;(2分)
;(2分)Ⅱ.⑴ 2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;(2分)
⑵ NaHSO3;(1分) c(Na+)>c(HSO
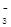 )>c(H+)>c(SO
)>c(H+)>c(SO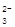 )>c(OH-) ;(2分)
)>c(OH-) ;(2分)⑶ D 。(2分)
试题分析:Ⅰ.根据元素周期表的结构判断①②③④⑤⑥分别是H、O、Na、Si、S、Cl元素。
(1)元素④Si在周期表中的位置是第三周期ⅣA族;
(2)②③⑤的原子半径由大到小的顺序为Na、S在第三周期,O在第二周期,Na在S的右侧,所以原子半径:Na>S>O;
(3)④⑤⑥元素的非金属性强弱顺序是Si<S<Cl,所以气态氢化物的稳定性由强到弱的顺序是HCl>H2S>SiH4;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO、NaClO3等,电子式为Na+
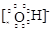 、
、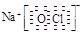 ;
;Ⅱ.(1)A是一种淡黄色固体,由A能与某种液体反应,说明A是过氧化钠,该液体是水,二者反应的化学方程式为2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;
(2)溶液B是氢氧化钠溶液,气体C是氧气,气体Y是一种大气污染物,直接排放会形成酸雨。说明气体Y是二氧化硫。二氧化硫与氢氧化钠1:1完全反应时的产物根据元素守恒法可判断为NaHSO3;NaHSO3溶液显酸性,说明HSO3-的电离程度大于其水解程度,所以溶液中的离子浓度的大小关系是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)F为硫酸,100 mL 18 mol/L的硫酸浓溶液中硫酸的物质的量是1.8mol,浓硫酸与Cu完全反应,最多生成0.9mol的二氧化硫,但随着反应的进行,硫酸浓度变稀,Cu不与稀硫酸反应,所以产生的二氧化硫的物质的量小于0.9mol,体积(标准状况)则小于20.16L,所以答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。

 键:
键:
 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。 的价层电子排布图为_____
的价层电子排布图为_____