题目内容
(13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
②1个 (HB=NH)3分子中有 个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。


(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。


(1) [Ar]3d10 ;结构上Cu2+为3d9,而Cu+为3d10全充满更稳定 (2) 原子晶体
(3) ① A ②12 (4) [BO2]nn-(或BO2-);sp2、sp3
(3) ① A ②12 (4) [BO2]nn-(或BO2-);sp2、sp3
试题分析:(1)Cu是29号元素。基态 Cu+ 的核外有28个电子。核外电子排布式为[Ar]3d10 ;在高温下CuO 能分解生成Cu2O,是因为CuO在变为Cu2O时,其中的Cu的结构由Cu2+的3d9变为3d10的全充满Cu+。更稳定的结构。(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于原子晶体。(3)①A. 在反应前后CH4中的碳原子的轨道杂化类型是sp3杂化,在反应后CO2中的碳原子的轨道杂化类型是sp杂化。轨道杂化类型改变。错误。B. CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形。正确。C. 一般情况下,同一周期的元素,元素的非金属性越强,原子半径越小,第一电离能越大。但是由于N原子的核外电子是处于半充满的稳定状态,所以其第一电离能比O盐酸的还大。因此第一电离能大小关系是:N>O>C>B。正确。D. 在化合物A中的N原子上存在配位键。正确。②由H3BNH3的分子结构可知在1个(HB=NH)3分子中有12个σ键.(4)由图(a)可知多硼酸根离子符号为BO2-或[BO2]nn-。由图(b)硼砂晶体可知:其中硼原子采取的杂化类型sp2、sp3 两种类型。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
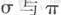 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。