题目内容
下列说法正确的是
| A.第三周期金属元素的氧化物都属于碱性氧化物 |
| B.电子层结构相同的不同离子,其半径随核电荷数增大而减小 |
| C.IA族元素的金属性一定比IIA族元素的金属性强 |
| D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |
B
Na2O2属于过氧化物(或复杂氧化物),而Al2O3属于两性氧化物,两者均不属于碱性氧化物,A错误;电子层结构相同的离子,随着核电荷数增大,原子核对核外电子的吸引能力增强,其离子半径减小,B正确;同周期的IA族元素的金属性比IIA族元素的金属性强,C错误;H+、Fe2+和Fe3+等离子均无对应的核外电子排布相同的稀有气体原子,D错误。

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
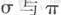 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。