题目内容
11.A~E等几种烃分子的球棍模型如图所示,据此回答下列问题.
(1)D的电子式为
 ,A的二氯取代物有1种.
,A的二氯取代物有1种.(2)可作为植物生长调节剂的是CH2=CH2(填结构简式);
(3)A与氯气反应可以生成多种物质,试任写其中一个反应的化学方程式:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl;
(4)C与水在一定条件下反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
分析 根据球棍模型可知,A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷.
(1)D为乙炔,甲烷是正四面体;
(2)乙烯是植物生长调节剂;(3)甲烷与氯气发生取代反应生成一氯甲烷和氯化氢;
(4)乙烯中含有碳碳双键,一定条件下,乙烯和水发生加成反应生成乙醇.
解答 解:(1)D的化学式为C2H2,电子式: ,甲烷是正四面体,二氯取代物1种,故答案为:
,甲烷是正四面体,二氯取代物1种,故答案为: ;1;
;1;
(2)乙烯有催熟作用,是植物生长调节剂,结构简式:CH2=CH2,故答案为:CH2=CH2;
(3)甲烷和氯气在光照条件下发生取代反应生成一氯甲烷和氯化氢,反应的方程式为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl;
(4)乙烯中含有碳碳双键,在一定条件下,乙烯和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
点评 本题考查了有机物结构与性质、球棍模型的表示方法,题目难度中等,注意掌握常见有机物结构与性质,明确球棍模型表示的意义是解答本题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.(1)为提纯下列物质(括号内为少量杂质),填写除杂质试剂及方法:
(2)某芳香族化合物的分子式为C7H8O,根据下列实验现象确定其结构简式(每小题只需给出一个答案即可):
①不能与金属钠反应,其结构简式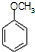 .
.
②能与钠反应,但遇FeCl3不显色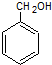 .
.
③能与钠反应且遇FeCl3显紫色的同分异构体共有3种,写出其中核磁共振氢谱吸收峰为
3:2:2:1的结构简式: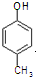 .
.
| 不纯物 | 除杂试剂 | 分离方法 |
| 乙烷(乙烯) | ||
| 苯(苯酚) | ||
| 乙醇(水) |
①不能与金属钠反应,其结构简式
 .
.②能与钠反应,但遇FeCl3不显色
 .
.③能与钠反应且遇FeCl3显紫色的同分异构体共有3种,写出其中核磁共振氢谱吸收峰为
3:2:2:1的结构简式:
 .
.
2.下列各组物质中互为同分异构体的是( )
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | C. | 淀粉和纤维素 | D. | 胶棉和火棉 |
6.下列说法错误的是( )
| A. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| B. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| C. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| D. | 聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
5.金属钛(Ti)硬度大、熔点高、常温下耐酸碱腐蚀,被誉为“未来金属”.以钛铁矿[主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质]为主要原料冶炼金属钛并获得副产品绿矾(FeSO4•7H2O)的工业生产流程如图1:
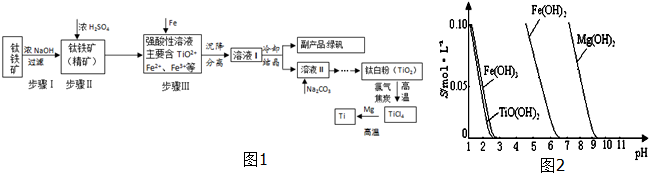
(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.试写出反应化学方程式:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)已知:TiO2+易水解,只能存在于强酸性溶液中. 25℃时,难溶电解质溶解度(s)与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29,若溶液中残留c(TiO2+)=1.0×10-5 mol•L-1,则调节溶液pH至少为3;步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
(3)对溶液Ⅱ进行加热,同时加入Na2CO3粉末的作用加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式
TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,该生产流程工艺中,可以循环使用的物质为H2SO4(填化学式)
(5)Mg还原TiCl4反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(6)为了测定绿矾中所含结晶水个数,可取样品进行灼烧,在灼烧时需要仪器除了三脚架、坩埚、石棉网、坩埚钳、酒精喷灯外还需要泥三角、玻璃棒.(填仪器名称)

(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.试写出反应化学方程式:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)已知:TiO2+易水解,只能存在于强酸性溶液中. 25℃时,难溶电解质溶解度(s)与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29,若溶液中残留c(TiO2+)=1.0×10-5 mol•L-1,则调节溶液pH至少为3;步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
(3)对溶液Ⅱ进行加热,同时加入Na2CO3粉末的作用加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式
TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,该生产流程工艺中,可以循环使用的物质为H2SO4(填化学式)
(5)Mg还原TiCl4反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
6.下列卤代烃中,能发生消去反应且能生成两种单烯烃的是( )
| A. | 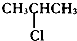 | B. | CH3CH2Cl | C. | 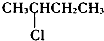 | D. | CH3CH2CH2Cl |
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率