题目内容
【题目】NaCN是重要的化工原料,可应用于冶金等领域,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_______________;
(2)现代开采金矿的流程如下:
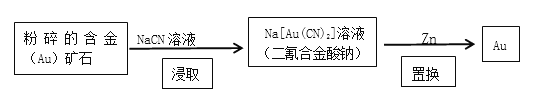
“粉碎”的目的是____________________;“浸取”反应的氧化剂是____________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式:________。
【答案】+2价 ![]() 增大接触面积,加快反应速率 O2 1∶2 Na2CO3 + C + 2NH3 =2NaCN + 3H2O
增大接触面积,加快反应速率 O2 1∶2 Na2CO3 + C + 2NH3 =2NaCN + 3H2O
【解析】
(1)在NaCN中,Na为+1价,N为-3价,根据化合物中正负化合价代数和为零,可推算出C的化合价;根据Na、C、N原子最外层电子数和NaCN属于离子化合物分析NaCN的电子式;
(2)“粉碎”的目的是增大接触面积,提高浸取速率;由NaCN、Au和Na[Au(CN)2]的化合价分析知,只有Au的化合价由0到+1价,其他化合价没有变化,这时考虑空气中的氧气参与了反应,再根据各物质得失电子数守恒分析解答;
(3)根据氧化还原的反应规律,Na2CO3中+4价的C和焦炭分子中0价的C发生归中反应,得到NaCN,再利用电子守恒法和原子守恒法来配平该方程式。
(1)在NaCN中,Na为+1价,N为-3价,则C的化合价为+2价,NaCN为离子化合物,电子式为![]() ,故答案为:+2价;
,故答案为:+2价;![]() ;
;
(2)“粉碎”的目的是增大接触面积,提高浸取速率;根据题意可知,NaCN溶液与Au以及空气中的氧气反应,得到Na[Au(CN)2](二氰合金酸钠)溶液,反应的化学方程式为:4 Au + 8NaCN + 2H2O + O2 = 4Na[Au(CN)2] +4NaOH,所以氧化剂是氧气,1mol Na[Au(CN)2]还原成1mol金得到1mol电子,1mol锌反应失去2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2,
故答案为:O2;1:2;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取NaCN,同时会生成水,Na2CO3中+4价的C和焦炭分子中0价的C发生归中反应,得到NaCN,反应的化学方程式为Na2CO3 + C + 2NH3 =2NaCN + 3H2O,故答案为:Na2CO3 + C + 2NH3 =2NaCN + 3H2O。

【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A. | 将2.5g CuSO4·5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B. | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
D. | 分别向2支试管中加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1FeCl3溶液 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D