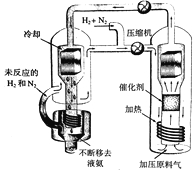
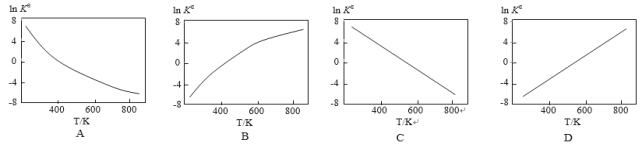
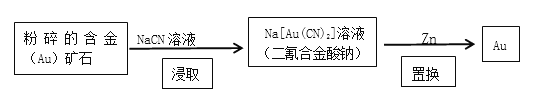
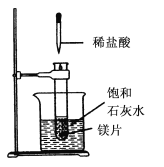
题目内容
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A. | 将2.5g CuSO4·5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B. | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
D. | 分别向2支试管中加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1FeCl3溶液 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
【答案】B
【解析】
A. 2.5gCuSO4·5H2O中CuSO4的质量为2.5g![]() =1.6g,溶液的质量为2.5g+97.5g=100g,则配制质量分数为1.6%的CuSO4溶液,所以A选项是正确的;
=1.6g,溶液的质量为2.5g+97.5g=100g,则配制质量分数为1.6%的CuSO4溶液,所以A选项是正确的;
B.NaClO具有强氧化性,不能用pH试纸测定浓度为0.1mol·L-1NaClO溶液的pH,则不能确定pH大小,不能比较酸性的强弱,故B错误;
C.向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,则发生沉淀的转化,说明一种沉淀能转化为另一种溶解度更小的沉淀,所以C选项是正确的;
D. 固定其他因素不变,过氧化氢浓度不同,反应速率不同,可研究浓度对反应速率的影响,所以D选项是正确的。
故答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目