题目内容
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:
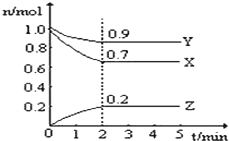
(1)该反应的化学方程式为______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为__________;
(3)平衡时容器内混合气体密度比起始时________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是_________。
2HI(g)达到平衡状态的是_________。
(2)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
【答案】3X(g)+ Y(g)![]() 2Z(g) 0.01molL-1min-1 相等 变大 7:5 ⑤ ②④
2Z(g) 0.01molL-1min-1 相等 变大 7:5 ⑤ ②④
【解析】
根据反应物生成物的变化量之比书写相应的反应方程式;根据速率表达式计算反应速率;根据密度公式及摩尔质量公式比较反应前后密度和摩尔质量的变化;运用三段式法进行相关计算;根据化学平衡状态的本质和特征分析反应达到平衡的标志。
(1)根据图示的内容知道,X和Y是反应物,Z为生成物,X、Y、Z的变化量之比是0.3:0.1:0.2=3:1:2,则反应的化学方程式为:3X(g)+ Y(g)![]() 2Z(g);
2Z(g);
(2)反应开始至2min,以气体Z表示的平均反应速率为:υ(Z)=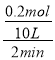 =0.01mol/(L·min);
=0.01mol/(L·min);
(3)混合气体密度![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;混合气体的平均相对分子质量
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;混合气体的平均相对分子质量![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,因此,本题正确答案是:相等;变大;
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,因此,本题正确答案是:相等;变大;
(4) 3X(g)+ Y(g)![]() 2Z(g) (设Y的变化量是x)
2Z(g) (设Y的变化量是x)
初始量 a b 0
变化量 3x x 2x
某时刻量 a-3x b-x 2x
当n(X)=n(Y)=2n(Z)时, a-3x=b-x=4x,则a=7x,b=5x,所以a:b=7:5;
Ⅱ.(1)①反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故①错误;②组分都是气体,气体质量不变,是恒容状态,容器的体积不变,因此密度不变,不能说明反应达到平衡,故②错误;③反应前后气体系数之和相等,因此物质的量不变,不能说明反应达到平衡,故③错误;④根据M=m/n,组分都是气体,气体质量不变,气体总物质的量不变,因此当M不变,不能说明反应达到平衡,故④错误;⑤I2是有颜色的气体,因此颜色不变,说明反应达到平衡,故⑤正确;⑥没有指明反应进行方向,故⑥错误;
(2)①反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故①错误;②A为固体,其余为组分都是气体,气体质量增加,是恒容状态,容器的体积不变,因此密度不变,说明反应达到平衡,故②正确;③气体物质的量不变,因此总物质的量不变,不能说明反应达到平衡,故③错误;④根据M=m/n,气体质量增加,气体物质的量不变,因此当M不变,说明反应达到平衡,故④正确;⑤题目中没有说明气体的颜色,因此颜色不变,不能说明反应达到平衡,故⑤错误;⑥没有指明反应进行方向,故⑥错误。
故答案为: (1). ⑤;(2)②④。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D