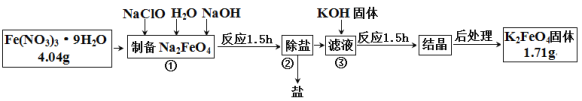
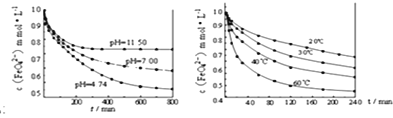
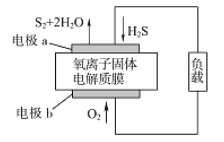
题目内容
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
【答案】O ![]()
![]() 第三周期第ⅣA族 H2SiO3 < H2SO4
第三周期第ⅣA族 H2SiO3 < H2SO4 ![]() Na+[ H∶]- H—C≡C—H 原子 2Na2O2 +2H2O = 4NaOH+O2↑ NA Na3N+4HCl = 3NaCl+NH4Cl
Na+[ H∶]- H—C≡C—H 原子 2Na2O2 +2H2O = 4NaOH+O2↑ NA Na3N+4HCl = 3NaCl+NH4Cl
【解析】
短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物,则A为H元素,C为O元素;元素C与元素F处于同一主族,F为S元素;元素C与元素D可形成D2C、D2C2两种化合物,则D为Na元素;元素B形成的化合物种类繁多,B为C元素;元素B与元素E处于同一主族,E为Si元素,结合元素周期律和物质的性质分析解答。
根据上述分析,A为H元素,B为C元素,C为O元素,D为Na元素,E为Si元素,F为S元素。
(1) C为O元素;D为Na元素,钠是11号元素,最外层有1个电子,Na+离子的结构示意图为![]() ,故答案为:O;
,故答案为:O;![]() ;
;
(2)H的质子数=1,中子数=2,则质量数=1+2=3,该核素的符号为![]() ,故答案为:
,故答案为:![]() ;
;
(3) E为Si元素,硅是14号元素,在周期表中位于第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(4) 非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性Si<S,最高价氧化物对应水化物的酸性H2SiO3 < H2SO4,故答案为:H2SiO3 < H2SO4;
(5)A2C2为H2O2,是共价化合物,电子式为![]() ;D与A形成化合物为NaH,是离子化合物,电子式为Na+[ H∶]-;A2B2为C2H2,结构式为H—C≡C—H,故答案为:
;D与A形成化合物为NaH,是离子化合物,电子式为Na+[ H∶]-;A2B2为C2H2,结构式为H—C≡C—H,故答案为:![]() ;Na+[ H∶]-;H—C≡C—H;
;Na+[ H∶]-;H—C≡C—H;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨,符合原子晶体的特点,故答案为:原子;
(7)C与D以原子个数比1∶1形成的化合物为Na2O2,Na2O2与水反应的化学方程式为2Na2O2 +2H2O = 4NaOH+O2↑;反应中Na2O2既是氧化剂又是还原剂,NaOH为还原产物,O2是氧化产物,生成0.5 mol氧化产物,转移1mol电子,数目为NA,故答案为:2Na2O2 +2H2O = 4NaOH+O2↑;NA;
(8)8.3g仅由Na和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,则8.3g该化合物中含有0.1molN元素,质量为1.4g,则含有Na元素8.3g-1.4g=6.9g,物质的量为![]() =0.3mol,该化合物的化学式为Na3N,则Na3N与过量盐酸反应的化学方程式为Na3N+4HCl = 3NaCl+NH4Cl,故答案为:Na3N+4HCl = 3NaCl+NH4Cl。
=0.3mol,该化合物的化学式为Na3N,则Na3N与过量盐酸反应的化学方程式为Na3N+4HCl = 3NaCl+NH4Cl,故答案为:Na3N+4HCl = 3NaCl+NH4Cl。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________