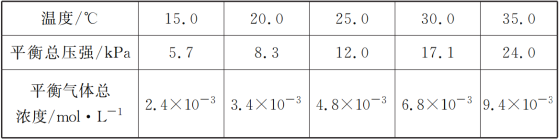
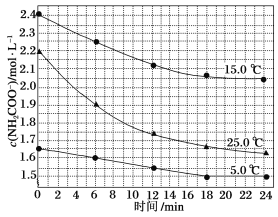
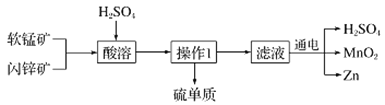
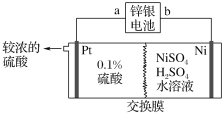
题目内容
【题目】氧化还原反应是重要的化学反应,在人类的生产和生活中无处不在。
(1)已知反应:BaSO4+C——BaS+CO↑
①配平该反应___。
②若有2.33gBaSO4发生反应,则反应过程中转移电子的数目是__,标准状况下,生成一氧化碳___L。
(2)已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
①配平并用“双线桥法”表示上述反应中电子转移的方向和数目___。
②该反应中氧化剂与还原剂的物质的量之比为__;写出该反应的离子方程式__。
【答案】BaSO4+4C=BaS+4CO↑ 0.08NA 0.896L  2:3 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O
2:3 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O
【解析】
根据氧化还原反应中得失电子守恒配平反应并用双线桥法表示;根据气体摩尔体积及反应方程式进行相关计算;根据离子方程式书写规则书写相关离子反应方程式。
(1)①反应中S元素化合价降低8,C元素化合价升高2,根据转移电子数守恒,配得C与CO系数为4,再运用观察法配平得:BaSO4+4C=BaS+4CO↑,故答案为BaSO4+4C=BaS+4CO↑;
②n(BaSO4)=![]() ,S元素化合价由+6降低为-2,则转移电子为0.01mol×8=0.08mol,即0.08NA;V(CO)=0.01mol×4×22.4L/mol=0.896L,故答案为0.08NA;0.896L;
,S元素化合价由+6降低为-2,则转移电子为0.01mol×8=0.08mol,即0.08NA;V(CO)=0.01mol×4×22.4L/mol=0.896L,故答案为0.08NA;0.896L;
(2)①该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,再根据原子守恒配平方程式,用双线桥标出该反应电子转移的方向和数目为: ,故答案为
,故答案为 ;
;
②该反应中还原剂为Cu,氧化剂为HNO3,参加反应的硝酸中只有1/4被还原,所以该反应中氧化剂与还原剂的物质的量之比为2:3,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O,故答案为2:3;3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案