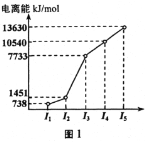
��Ŀ����
����Ŀ��п����صĸ���Ϊп������Ϊ���������������KOH����ط�ӦΪZn��Ag2O��H2O=Zn(OH)2��2Ag����п�����Ϊ��Դ�������������Һұ��������װ����ͼ��ʾ��
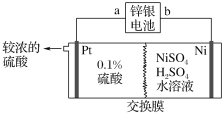
����˵����ȷ���ǣ� ��
A.װ����ʹ�������ӽ���Ĥ
B.п�����a����ӦʽΪAg2O��H2O��2e��=2Ag��2OH��
C.���������ϡ���ᣬ����õ��Ƚ�Ũ������
D.��п������ܽ�13gп�������������������Ϊ5.9g
���𰸡�AB
��������
A. ����Ĥ�����������Ũ������˵����������Ӵ��Ҳ�������࣬����װ����ʹ�������ӽ���Ĥ����A��ȷ��
B. �����������Һұ�����������Ե����Ҳ���������п����ص�b���Ǹ�����a������������ԭ��Ӧ��a����ӦʽΪAg2O��H2O��2e��=2Ag��2OH������B��ȷ��
C. ���������ϡ���ᣬ���������ӷŵ�������������C����
D. ��п������ܽ�13gп�����·��ת�Ƶ���![]() 0.4mol���������������������
0.4mol���������������������![]() 11.8g����D����
11.8g����D����
��ѡAB��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | ��̿���ڸ��������»�ԭCuO |
����b | ��ⷨ����ӦΪ2Cu+H2O |
��1����ҵ�ϳ��÷���b��ȡCu2O�������÷���a����ԭ���Ƿ�Ӧ���������ƣ������²���������___��ʹCu2O���ʽ��͡�
��2����֪����2Cu(s)+![]() O2(g)=Cu2O(s) ��H1=��169kJ��mol��1
O2(g)=Cu2O(s) ��H1=��169kJ��mol��1
��C(s)+![]() O2(g)=CO(g) ��H2=��110.5 kJ��mol��1
O2(g)=CO(g) ��H2=��110.5 kJ��mol��1
��Cu(s)+![]() O2(g)=CuO(s) ��H3=��157 kJ��mol��1
O2(g)=CuO(s) ��H3=��157 kJ��mol��1
��a�з����ķ�Ӧ��2CuO(s)��C(s)=Cu2O(s)��CO(g)����H=___��
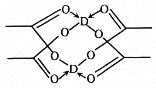
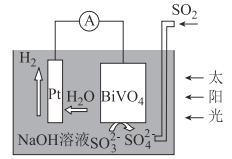
��3������b������ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH����Ũ�����Ʊ�����Cu2O��װ����ͼ��ʾ��
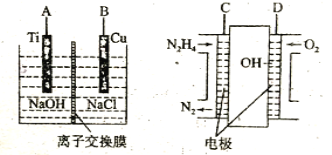
������װ����B�缫Ӧ��___�缫(�C����D��)��
�ڸ����ӽ���ĤΪ___���ӽ���Ĥ(�����������)���õ��ص�������ӦʽΪ___��
��ԭ����и�����ӦʽΪ___��
����Ŀ����ˮ��������M�ķֽ�����Ӱ�����ؽ����о�������ͬ�¶��£�M�����ʵ���Ũ��(mol��L-1)��ʱ��(min)�仯���й�ʵ�����ݼ��±���
ʱ�� ˮ�� | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
��(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4���� Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
����˵������ȷ���ǣ� ��
A.����Cu2+���ڣ�IV��M�ķֽ����ʱ�I��
B.����������ͬʱ��ˮ������Խǿ��M�ķֽ�����Խ��
C.��0��25 min�ڣ�����M�ķֽ�ٷ��ʱ�II
D.��0��20 min�ڣ�I��M��ƽ���ֽ�����Ϊ0.015mol/(L��min)
����Ŀ����֪������̼�ᡢ�����ᡢ������ĵ���ƽ�ⳣ�����±�:
H2CO3 | H2SO3 | HClO |
K1=4.30��10-7 | K1=1.54��10-2 | K=2.95��10-8 |
K2=5.61��10-11 | K2=1.02��10-7 |
����˵����ȷ����
A. ��ͬ������,ͬŨ�ȵ� H2SO3��Һ�� H2CO3��Һ�����ԣ� ���߸�ǿ
B. Na2CO3��Һ��ͨ������SO2�� 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO ��Һ��ͨ������CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. ����ˮ�зֱ�����Ũ�ȵ� NaHCO3 �� NaHSO3��Һ,���������ˮ�� HClO ��Ũ��