��Ŀ����
����Ŀ��Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeSO4��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=1������Fe2+��Fe3+��ˮ�⣩��FeSO4��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeSO4��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
��1��д����Ӧ���漰�Ļ�ѧ����ʽ������3����__��__��__
��2��ͨ�����㣬��д�±���
c��H+�� | c��SO42���� | c��Fe2+��Fe3+�� |
__ | __ | __ |
ע��c��Fe2+��Fe3+����ʾFe2+��Fe3+���ܵ����ʵ�����Ũ��
��3������ԭ��Һ��Fe2+�������İٷ���__��
���𰸡�BaCl2+FeSO4=BaSO4��+FeCl2 FeCl2+2NaOH=Fe��OH��2��+2NaCl 2Fe��OH��3![]() Fe2O3+3H2O 0.1mol/L 0.6mol/L 0.5mol/L 20%
Fe2O3+3H2O 0.1mol/L 0.6mol/L 0.5mol/L 20%
��������
(1)������Ϣд����Ӧ����ʽ��
(2)����pH��1��֪����Һ��������Ũ����0.1mol/L��28.0g���������ᱵ�����ʵ�����0.12mol��Ũ����![]() =0.6mol/L��8.0g�����������������ʵ�����0.05mol��������ԭ�ӵ����ʵ�����0.1mol�����Fe2+��Fe3+���ܵ����ʵ�����Ũ����
=0.6mol/L��8.0g�����������������ʵ�����0.05mol��������ԭ�ӵ����ʵ�����0.1mol�����Fe2+��Fe3+���ܵ����ʵ�����Ũ����![]() ��0.5mol/L��
��0.5mol/L��
(3)���ݵ���غ���м��㡣
(1)FeSO4��Һ200mL�����������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����27.96gΪ���ᱵ��������Ӧ��ѧ����ʽΪ��BaCl2+FeSO4=BaSO4��+FeCl2������ȡͬ����FeSO4��Һ200mL�������м��������NaOH��Һ������ʹ���ַ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��FeCl2+2NaOH=Fe(OH)2��+2NaCl��������ȫ����Ϊ���ɫ��ӦΪ��4Fe(OH)2+O2+2H2O=4Fe(OH)3�����ˡ�ϴ�Ӳ��������ù��壬���յõ����������Ϊ8.00gΪFe2O3����Ӧ�Ļ�ѧ����ʽΪ��BaCl2+FeSO4=BaSO4��+FeCl2�� FeCl2+2NaOH=Fe(OH)2��+2NaCl��2Fe(OH)3![]() Fe2O3+3H2O��
Fe2O3+3H2O��
(2)��pH=1��c(H+)=0.1molL-1
��SO42-+Ba2+=BaSO4����c(SO42-)=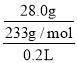 =0.6molL-1��
=0.6molL-1��
��Ϊ���չ�������ΪFe2O3��
����n(Fe2O3)=![]() =0.05mol
=0.05mol
����Ԫ���غ�ã�
c(Fe2+��Fe3+)=![]() =0.5mol/L��
=0.5mol/L��
(3)����غ㣺2c(Fe2+)+3c(Fe3+)+c(H+)=2c(SO42-)��
2c(Fe2+)+3c(Fe3+)=1.1mol/L��
c(Fe2+)��c(Fe3+)=0.5mol/L
c(Fe2+)=0.4mol/L
c(Fe3+)=0.1mol/L
FeSO4��Һ��Fe2+�������İٷ��ʣ�![]() =20%��
=20%��
��ԭ��Һ��Fe2+�������İٷ���Ϊ20%��

����Ŀ��������ĿҪ��ش��������⡣
(1)�����£�Ũ�Ⱦ�Ϊ0.1 mol/L������������Һ��pH�����ʾ��
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
����������Һ�е������ӽ��H+������ǿ����________��
�ڸ��ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01 mol/L�������������ʵ���Һ�У�������ǿ����________(����ĸ��ţ���ͬ)��������Һ�ֱ�ϡ��100����pH�仯��С����________��
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
�����й���NaHCO3������Һ�ı�������ȷ����________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-�ĵ���̶ȴ���HCO3-��ˮ��̶�
�ܸ����ϱ����ݣ������ж����з�Ӧ���ܳ�������________��
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
��Ҫ������ˮ��![]() ��Ũ�ȣ�������ˮ�м���������̼��������Һ��д��Cl2��HCO3-��Ӧ�����ӷ���ʽΪ________��
��Ũ�ȣ�������ˮ�м���������̼��������Һ��д��Cl2��HCO3-��Ӧ�����ӷ���ʽΪ________��
(2)���ݱ������ݼ���CH3COOH�ĵ��볣��Ka=________(��֪100.4=2.5���ÿ�ѧ��������ʾ)