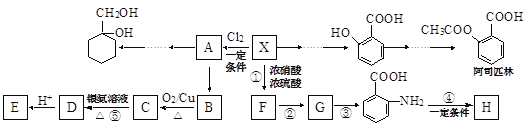
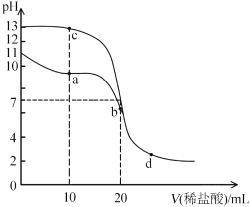
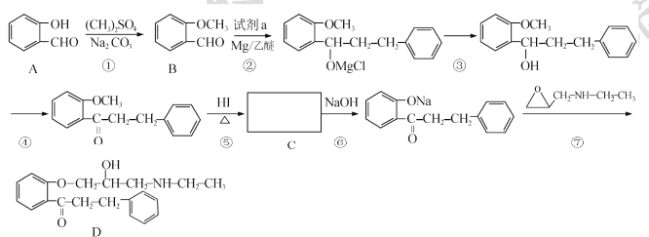
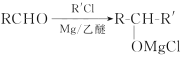
题目内容
【题目】依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是________。
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是________(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是________。
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是________。
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中![]() 的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
(2)依据表中数据计算CH3COOH的电离常数Ka=________(已知100.4=2.5,用科学计数法表示)
【答案】CO32- d c A d Cl2+HCO3-=CO2+Cl-+HClO 2.5×10-5
【解析】
(1)①弱酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大;
②酸的酸性越强,酸的电离程度越大,其酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小;加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,弱酸的酸性越弱,该酸的pH变化越小;
③根据物料守恒、电荷守恒、质子守恒,根据NaHCO3溶液的pH分析判断;
④据强酸制取弱酸的原理分析判断;
⑤HClO和碳酸氢钠不反应,盐酸和碳酸氢钠反应生成二氧化碳;
(2)根据电离平衡常数的定义式及电离平衡常数与盐水解常数关系分析。
(1)①弱酸的酸性越弱,弱酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大,根据溶液pH知,CO32-的水解程度最大,则CO32-结合质子能力最强;
②酸的酸性越强,酸的电离程度越大,其酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,根据表中数据知,酸性最强的酸是CH3COOH,合理选项是d;
弱酸在溶液中存在电离平衡,加水稀释电离平衡正向移动,促进弱酸电离。相同浓度的不同弱酸稀释相同的倍数,弱酸的酸性越弱,该酸的pH变化越小,在上述几种弱酸中,酸性最弱的酸是C6H5OH,则稀释相同倍数时溶液pH变化最小的是C6H5OH,故合理选项是c;
③A.根据物料守恒可得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),A正确;
B.根据电荷守恒可得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),B错误;
C. HCO3-是弱酸的酸式酸根离子,在溶液中存在电离平衡:HCO3-![]() CO32-+H+,电离产生H+,使溶液显酸性;也存在水解作用:HCO3-+H2O
CO32-+H+,电离产生H+,使溶液显酸性;也存在水解作用:HCO3-+H2O![]() H2CO3+OH-,水解存在OH-,使溶液显碱性,由0.1 mol/L NaHCO3的pH=9.7,溶液显碱性,说明HCO3-的水解程度大于其电离程度,C错误;
H2CO3+OH-,水解存在OH-,使溶液显碱性,由0.1 mol/L NaHCO3的pH=9.7,溶液显碱性,说明HCO3-的水解程度大于其电离程度,C错误;
故合理选项是A;
④据各种酸对应钠盐的pH可知,溶液的酸性:CH3COOH>H2CO3>HClO>HCN>C6H5OH>HCO3-。
a.由于醋酸的酸性比碳酸强,所以反应CH3COOH+Na2CO3=NaHCO3+CH3COONa可以发生,a不符合题意;
b.由于酸性醋酸的比HCN强,所以CH3COOH+NaCN=CH3COONa+HCN可以发生;b不符合题意;
c.由于酸性:H2CO3>HClO>HCO3-,所以可以发生反应:CO2+H2O+NaClO=NaHCO3+HClO,c正确;
d.由于酸性:H2CO3>C6H5OH>HCO3-,所以CO2气体通入C6H5ONa溶液中,会发生反应:碳酸的比HClO强,所以碳酸的酸性比苯酚强,苯酚的酸性比HCO3-强,所以CO2+H2O+C6H5ONa=NaHCO3+C6H5OH可发生,而CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH不能发生,d错误,
故合理选项是d;
⑤在氯水中存在化学平衡:Cl2+H2O![]() HCl+HClO,由于酸性HCl>H2CO3>HClO>HCO3-,所以HClO和NaHCO3不反应,盐酸和碳酸氢钠反应生成二氧化碳,所以导致氯水中HClO浓度增大,离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO;
HCl+HClO,由于酸性HCl>H2CO3>HClO>HCO3-,所以HClO和NaHCO3不反应,盐酸和碳酸氢钠反应生成二氧化碳,所以导致氯水中HClO浓度增大,离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO;
(2)CH3COONa在溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,0.1 mol/L CH3COONa溶液pH=8.8,c(H+)=10-8.8,则由于室温下水的离子积常数Kw=10-14,c(OH-)=
CH3COOH+OH-,0.1 mol/L CH3COONa溶液pH=8.8,c(H+)=10-8.8,则由于室温下水的离子积常数Kw=10-14,c(OH-)=![]() =10-5.2,根据水解平衡可知水解产生的CH3COOH、OH-浓度相等,水解平衡常数Kh=
=10-5.2,根据水解平衡可知水解产生的CH3COOH、OH-浓度相等,水解平衡常数Kh= =10-9.4;由于水解平衡常数与相应弱酸的电离平衡常数关系为Ka·Kh=Kw,所以在该温度下CH3COOH的电离平衡常数Ka=
=10-9.4;由于水解平衡常数与相应弱酸的电离平衡常数关系为Ka·Kh=Kw,所以在该温度下CH3COOH的电离平衡常数Ka=![]() =10-4.6=10-5+0.4=100.4×10-5=2.5×10-5。
=10-4.6=10-5+0.4=100.4×10-5=2.5×10-5。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.